Pour vivre, les hommes, les plantes et les animaux ont besoin d'air : il est donc indispensable à la vie sur Terre.
L'air est un mélange de plusieurs gaz. Sa composition fut établie par Antoine Lavoisier en .
I. Les atomes et les molécules
La matière est constituée de particules fondamentales appelées atomes. Les atomes peuvent se lier pour former des molécules :
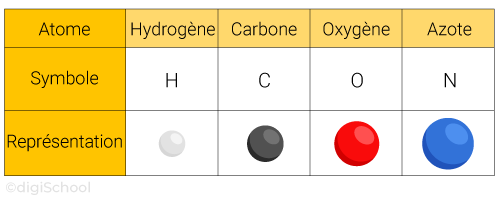
Atomes : ce sont les constituants élémentaires de la matière.
Exemples :
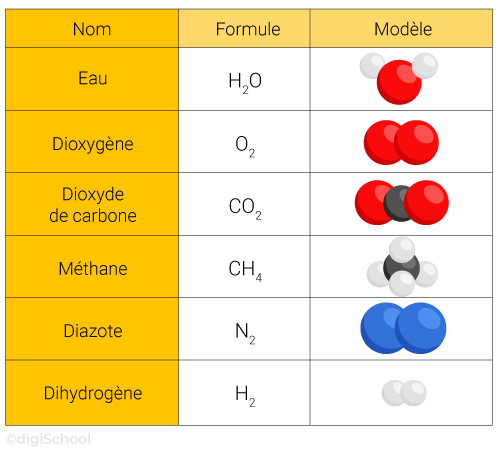
Molécules : elles sont formées par la combinaison de deux ou plusieurs atomes liés chimiquement.
Exemples :
Exemples de décomposition des molécules :
L'eau () est une molécule composée de atomes d'hydrogène et d' atome d'oxygène ;
Le dioxyde de carbone () est une molécule composée d' atome de carbone et de atomes d'oxygène ;
Le méthane () est une molécule composée d' atome de carbone et de 4 atomes d'hydrogène.
II. La composition de l'air
1. Proportion des gaz dans l'air
L'air est un mélange transparent de plusieurs gaz mais ses deux principaux constituants sont :
Le dioxygène ;
Le diazote ;
L'air contient aussi d'autres gaz appelés « gaz nobles » (anciennement appelés « gaz rares ») : l'argon, le néon, l'hélium, le krypton et le xénon. Enfin, l'air contient une infime proportion de gaz à effet de serre : le dioxyde de carbone, le méthane et la vapeur d'eau.
Les proportions des différents gaz qui composent l'air sont :
Le dioxygène : environ ;
Le diazote : environ ;
Les gaz nobles environ ;
Le dioxyde de carbone, le méthane et la vapeur d'eau : environ .
Remarque : à des fins de simplification, il sera d'usage de dire que l'air est composé approximativement à de diazote et à de dioxygène.
2. L'air, un mélange de molécules
L'air est un mélange car il est constitué de molécules différentes, principalement :
Le dioxygène est un corps pur composé de atomes d'oxygène (de formule ), sa formule brute chimique est donc ;
Le diazote est aussi un corps pur composé de atomes d'azote (de formule N), sa formule brute chimique est donc .
Rappel : un mélange est une substance (liquide, solide ou gaz) constituée de plusieurs corps purs.
Interprétation des proportions de l'air (approximation usuelle) :
Dans un volume d' litre d'air, il y a environ litre de diazote et litre de dioxygène soit en proportion : litre de diazote et litre de dioxygène.
L'air contient aussi environ molécules de diazote pour molécule de dioxygène.
Ainsi on peut dire que la composition de l'air en volume est identique à sa composition en molécules.
3. L'air à l'origine de la vie
Le constituant vital de l'air est le dioxygène, celui-ci ravive une flamme, il permet les combustions et la respiration.
Le diazote, avec un pourcentage élevé dans l'air, empêche que le dioxygène endommage le système respiratoire lors de la respiration. Pourtant son nom tiré du grec, signifie « qui n'entretient pas la vie » et Lavoisier l'appela azote après avoir constaté « la propriété qu'a ce gaz de priver de la vie, les animaux qui le respirent ». Comme cela a été vu précédemment, le diazote, à température ambiante, est un gaz constituant la plus grande partie de l'atmosphère : l'air sec en contient . L'industrie utilise cette source peu onéreuse pour la préparation de diazote pur. Malgré son nom, l'azote est fixé dans le sol par des microorganismes, sous forme de composés simples, qui sont ensuite absorbés par les végétaux, qui l'utiliseront à leur tour pour la synthèse des protéines, dont les animaux tirent ensuite parti.
III. Les propriétés de l'air
1. Masse de l'air
L'air est de la matière, il a donc une masse. Par le biais d'une expérience, il est possible de déterminer que la masse d' litre d'air est de gramme à la température de et à la pression atmosphérique de hectopascals.
Introduction à la notion de masse volumique :
La masse volumique est une propriété physique qui permet de caractériser la matière. Elle est définie comme la masse d'une substance par unité de volume.
La relation à connaître pour calculer la masse volumique est :
où :
est la masse volumique (en ou ),
est la masse de l'échantillon (en ou ),
est le volume de l'échantillon (en ou ).
Mesure expérimentale : cas d'un solide irrégulier (une pierre par exemple)
On utilise une balance pour déterminer la masse de la pierre ;
On remplit une éprouvette graduée d'eau et on lit le volume en regardant la graduation de l'éprouvette ;
On plonge la pierre dans l'éprouvette et on lit le volume . Le volume de la pierre est la différence entre le deuxième et le premier volume (attention : la lecture de la graduation se fait en lisant au bas du ménisque, forme arrondie de la surface libre) ;
Il est dès lors possible de déterminer sa masse volumique par le biais de la formule explicitée ci-dessus.
Remarque : la masse volumique étant caractéristique à chaque solide, liquide ou gaz, sa détermination permet de déterminer sa nature et ses propriétés physiques.
2. L'air conducteur d'électricité et de chaleur (hors programme)
L'air est un mélange qui conduit l'électricité (d'où la possibilité de voir un éclair dans la nature en cas d'orage) ;
L'air est un mélange de molécules de dioxygène et de molécules de diazote, ce mélange est possible car les molécules qui les composent sont éloignées les unes des autres et se déplacent à grande vitesse dans toutes les directions. Les chocs plus ou moins fréquents de ces molécules contre les parois expliquent les variations de pression et de température des gaz (donc de l'air). Cette "agitation thermique" augmente avec la température. Cette propriété de l'air sera vue plus en détail au lycée.
3. L'air dans tous ses états
Les états de l'eau ont été vus en classe de 5e dans la fiche de cours suivante :
L'air étant également de la matière, ce dernier peut également être dans un de ces états physiques.
L'air qui nous entoure est à l'état gazeux dans des conditions normales de pression et de température.
Propriété de l'air à l'état gazeux :
L'air n'a pas de volume propre, on peut diminuer ou augmenter le volume qu'il occupe : on dit que l'air est compressible et expansible.
Qu'il soit comprimé ou détendu, l'air tend à revenir spontanément à son volume initial : on dit que l'air est élastique.
Le nombre de molécules contenues dans un certain volume d'air reste identique à lui-même lorsque ce volume augmente ou diminue. En revanche, la pression augmente lorsque le volume diminue (l'air se trouve comprimé). Inversement, la pression diminue lorsque le volume augmente (l'air se trouve détendu).
L'air comprimé, que l'on obtient lorsque l'on soumet l'air à une pression supérieure à celle de l'atmosphère, a de nombreuses applications : on en fait une utilisation directe, par exemple pour le gonflage des pneus ou une utilisation indirecte dans les machines, par exemple dans certains manèges des forains.
Les changements d'états de l'eau ont été vus en classe de 5e dans la fiche de cours suivante :
Changements d'état de l'eau : approche phénoménologique
L'air a la propriété d'être liquéfié, c'est-à-dire qu'il peut passer de l'état gazeux à l'état liquide. Cependant, pour réaliser ce changement d'état, il faut réunir des conditions de température et de pression très précises. On obtient ainsi de l'air liquide qui est transparent, à peu près incolore s'il a une faible teneur en oxygène (tirant vers le bleu lorsque la teneur en oxygène augmente).
En plus de son utilisation en laboratoire, l'air liquide permet d'obtenir et de maintenir des températures très basses. L'air liquide est aussi produit pour obtenir de l'oxygène, de l'azote et de l'argon par distillation fractionnée.
IV. Comment récupérer un gaz dissout dans l'eau et le reconnaître ?
1. Rappel : les mélanges aqueux
Les mélanges aqueux (homogènes ou hétérogènes) et leurs techniques de séparation ont été introduits en classe de 5e dans la fiche de cours suivante :
Etude des mélanges - Notion de corps pur
La notion de solubilité a été introduite également en 5e dans la fiche de cours suivante :
2. Protocole expérimental : récupération des gaz
Une phase aqueuse peut contenir un ou plusieurs gaz dissous (l'eau pétillante, le cola, etc.).
Ces gaz ne peuvent pas être récupérés avec le protocole expérimental suivant :
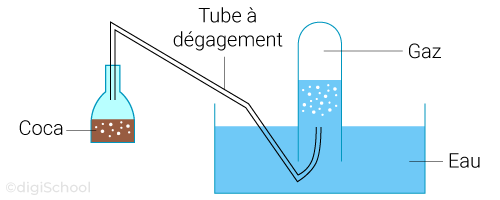
Pour ce faire, on utilise un système de récupération de gaz par "déplacement" d'eau ;
Le gaz va s'échapper de la bouteille pour aller dans le tube à dégagement et va ensuite venir remplacer l'eau dans le tube à essai. En effet, la masse volumique d'un gaz est inférieure à celle de l'eau à l'état liquide ;
Il faut faire attention à ce que le gaz ne se mélange pas à l'eau. Dans le cas contraire, il faut remplacer l'eau par un autre solvant.
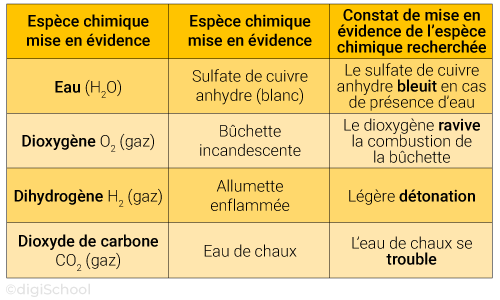
3. Test de reconnaissance des principaux gaz
Les principaux tests de reconnaissance sont synthétisés dans le tableau suivant :
Remarque : pour l'eau le test au sulfate de cuivre anhydre est aussi valable à l'état gazeux comme cela a été vu en classe de 5e.