I. Corps pur et mélange
1. L'eau minérale est-elle un mélange homogène ?
L'eau pure a pour formule . Mais l'eau que nous buvons est-elle uniquement composée de molécules ?
Voici l'étiquette d'une bouteille d'eau minérale naturelle :
Calcium : ;
Bicarbonates : ;
Magnésium : ;
Sulfates : ;
Sodium : ;
Nitrates : ;
Potassium : ;
Chlorures : .
À partir de là, il est clair que l'eau que nous buvons n'est pas composée uniquement d'eau pure.
Les espèces chimiques qui se trouvent dans l'eau pure donnent à chaque source des qualités différentes.
En conclusion, une eau d'apparence homogène peut contenir d'autres substances que l'eau.
Expérience par évaporation :
Grâce à une expérience très simple, il est possible de démontrer que des liquides d'apparence homogène peuvent contenir d'autres composés.
Pour ce faire, 1 litre de cette eau minérale (dont l'étiquette est ci-dessus) est versée dans un bécher et est chauffée à .
En éliminant totalement l'eau, on obtient en moyenne d'un résidu sec solide. Ceci illustre bien le fait que l'eau minérale n'est pas pure.
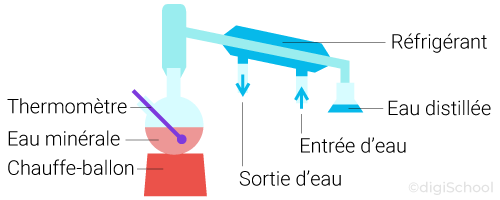
2. Distillation de l'eau minérale
Il a été vu précédemment que le chauffage de l'eau minérale permettait l'obtention d'un résidu sec correspondant aux espèces chimiques contenues dans l'eau.
La vapeur ainsi éliminée ne contenait donc pas ces composés. Si était possible de liquéfier cette vapeur, l'eau ainsi obtenue serait pure (eau distillée).
Comme son nom l'indique, l'eau distillée est obtenue par distillation de l'eau minérale :
L'eau pure va s'évaporer dans le tube puis se liquéfier dans le réfrigérant et tomber dans l'erlenmeyer.
Le distillat sera donc de l'eau pure et le résidu de distillation, le solide restant.
3. Définitions
Un corps pur est une substance constituée d'atomes ou de molécules de la même espèce chimique (par exemple l'eau pure ne contient que des molécules ). En d'autres termes, cette espèce chimique ne peut pas être décomposée, c'est-à-dire qu'elle ne comporte pas plusieurs espèce chimiques différentes (c'est-à-dire qu'un seul constituant).
Un mélange est une substance (liquide, solide ou gaz) constituée de plusieurs corps purs.
Remarques :
Un mélange est donc une introduction dans un même récipient de plusieurs substances qui n'ont pas forcément le même état ;
Un mélange aqueux est un mélange contenant de l'eau liquide.
III. Les mélanges homogènes et hétérogènes
1. Rappels
Lorsque deux substances sont mélangées, il peut y avoir 2 cas rencontrés : le mélange homogène et le mélange hétérogène. Ces derniers ont été introduits dans la fiche de cours suivante :
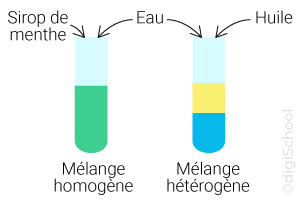
Mélange homogène : mélange contenant des substances que l'on ne peut pas distinguer les unes des autres ;
Mélange hétérogène : mélange contenant des substances que l'on peut distinguer les unes des autres.
Exemples :
Mélanges homogènes :
Eau + Cola frais ;
Vinaigre + Jus de citron ;
Cola + Jus de citron ;
Eau gazéifiée + Vinaigre d'alcool ;
Eau + Vinaigre de vin ;
Mélanges hétérogènes :
Huile + Vinaigre de vin ;
Huile + Cola ;
Huile + Vinaigre d'alcool ;
Eau gazéifiée + Huile ;
Eau + Huile.
II. Obtention d'une solution aqueuse limpide à partir d'un mélange hétérogène
1. La décantation (rappel)
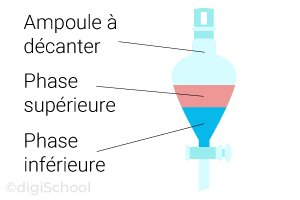
Définition :
La décantation consiste à séparer les phases d'un mélange hétérogène liquide.
Elle se fait dans une ampoule à décanter.
Protocole expérimental :
On introduit le mélange hétérogène dans l'ampoule à décanter et on attend que les 2 phases se séparent : c'est la phase de décantation ;
Une fois que les deux phases sont nettement séparées, on ouvre le robinet afin de récupérer (ou d'éliminer) la phase située en dessous (ici, la phase aqueuse) : c'est la phase de séparation ;
Les phases sont séparées, l'opération est terminée.
Remarque :
La position de la phase organique ne sera pas la même suivant la masse volumique (voire la densité) du solvant extracteur par rapport à celle du solvant de départ :
Si sa masse volumique lui est inférieure, alors la phase organique sera au-dessus du solvant de départ ;
Si sa masse volumique lui est supérieur, alors la phase organique sera en-dessous du solvant de départ.Cette notion de masse volumique sera vue plus en détail en classe de 4e.
2. La filtration (rappel)
Définition :
La filtration consiste à séparer la phase solide de la phase liquide d'un mélange.
Elle se fait à l'aide d'un entonnoir et d'un papier filtre.
Protocole expérimental :
On introduit le mélange (dans notre exemple, il s'agit d'eau et de sable) dans l'entonnoir muni du papier filtre ;
Le liquide va s'écouler à travers le papier filtre alors que le sable va être retenu ;
Il ne faut pas oublier d'agiter le sable car il pourrait bloquer la sortie de la phase aqueuse ;
L'opération est terminée quand la totalité de la phase aqueuse de l'entonnoir est dans le tube à essai.
3. La centrifugation (pour aller plus loin) :
Définition :
La centrifugation est une méthode de séparation consistant à faire tourner le produit à grande vitesse afin d'en séparer les constituants.
Exemple : les apiculteurs utilisent de procédé pour extraire le miel des alvéoles constituées par les abeilles.
III. Obtention d'une solution aqueuse limpide à partir d'un mélange homogène
1. Par chauffage (rappel)
Cette méthode a été introduite au §I.
Définition :
Température d'ébullition : température de passage de l'état liquide à l'état gazeux.
Protocole expérimental :
Le chauffage peut uniquement être utilisé si la phase à éliminer est plus volatile que l'eau.
L'opération consiste à porter le mélange à la température d'ébullition (plus basse que celle de l'eau).
Arrivé à cette température d'ébullition, cette substance va se vaporiser, laissant l'eau dans son état liquide.
Au bout d'une certaine durée de chauffage, il peut être arrêté. Il nous reste alors de l'eau liquide si la température d'ébullition est inférieure à (correspondant à celle de l'eau pure dans des conditions normales de pression).
2. Par distillation (rappel)
Cette opération peut être utilisée quelle que soit la température d'ébullition du composé à éliminer. Elle a également été introduite au §I.
La technique est la même que pour le chauffage sauf que dans le cas de la distillation, la vapeur qui va s'élever dans le tube va se liquéfier dans le réfrigérant.
Le composé récupéré s'appelle le distillat et ce qui reste dans le ballon est appelé résidu de distillation.
= Merci à Skops pour avoir contribué à l'élaboration de cette fiche =