I. Le cycle de l'eau
1. Le cycle de l'eau dans la nature
L'eau recouvre environ de la surface de la planète et est présente en très grande quantité : mer, océan, lac, rivière, nappe phréatique, neige, calotte glacière, atmosphère, etc.
On estime la quantité d'eau à environ litres !
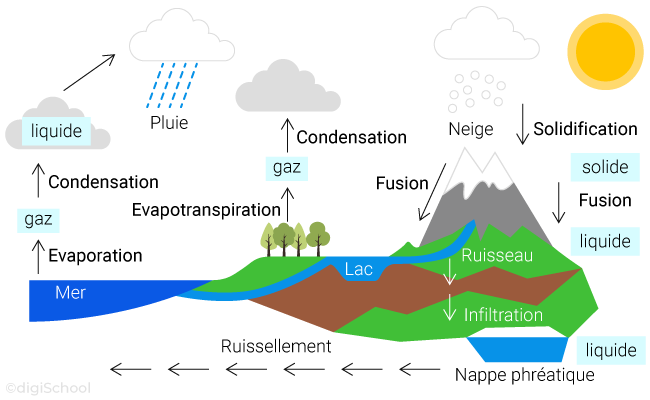
Cette eau qui nous entoure suit un cycle, dénommé simplement le "cycle de l'eau" :
Il existe trois états physiques pour l'eau :
L'état solide qui correspond à celui de la glace ;
L'état liquide, qui correspond à celui de la goutte d'eau par exemple ;
L'état gazeux qui correspond à celui de la vapeur d'eau.
2. Les changements d'états de l'eau
Définition :
Le passage d'un état physique à un autre est appelé changement d'état.
Chaque changement d'état porte un nom qui lui est propre :
Le passage de l'état solide à l'état liquide est appelé la fusion ;
Le passage de l'état liquide à l'état solide est à contrario appelé la solidification ;
Le passage de l'état liquide à l'état gazeux est appelé l’évaporation ;
Le passage de l'état gazeux à l'état liquide est à contrario appelé la liquéfaction (souvent désignée abusivement par "condensation") ;
Le passage de l'état gazeux à l'état solide est appelé la condensation ;
Le passage de l'état solide à l'état gazeux est à contrario appelé la sublimation.
Schéma de synthèse :
II. Test de reconnaissance de l'eau
1. Définitions
Test de reconnaissance : expérience rapide permettant de mettre en évidence une substance.
Anhydre : ne contenant pas d'eau.
2. Chauffage du sulfate de cuivre : expérience
Le sulfate de cuivre hydraté est une poudre de couleur bleue contenant de l'eau.
Afin de pouvoir mettre en évidence la présence d'eau, le sulfate de cuivre va être tout d'abord chauffé, afin d'éliminer l'eau qu'il contient (= il est déshydraté) :
Conclusion :
Le sulfate de cuivre anhydre (ou déshydraté) est blanc ;
Ainsi, le sulfate de cuivre anhydre bleuit au contact de l'eau : il est alors hydraté.
3. Mise en évidence de la présence d'eau par le sulfate de cuivre
Un peu de sulfate de cuivre anhydre est versé sur le composé à analyser. Si le sulfate de cuivre anhydre devient bleu alors le composé contient de l'eau.
Tableau de différents aliments avec les résultats du test :
Aliment à tester | Couleur du sulfate de cuivre | Contient-t-il de l'eau ? |
|---|---|---|
Tomate | Bleu | Oui |
Fruit | Bleu | Oui |
Huile | Blanc | Non |
Sel ou sucre | Blanc | Non |
Haricot | Bleu | Oui |
Dans l'air, y a-t-il de l'eau ?
Si on laisse du sulfate de cuivre à l'air libre pendant plusieurs heures, on constate qu'il bleuit : l'air contient donc de l'eau.
III. L'eau et les organismes vivants
L'eau est absorbée par l'être humain sous forme liquide (environ à litres par jour).
Elle est rejetée de différentes manières : dans l'air (expiration), par la peau (transpiration), par le sang et par l'urine.
L'eau est extrêmement importante pour l'être humain car elle permet un bon fonctionnement de la circulation sanguine, l'hydratation des tissus, la digestion, etc.
Une déshydratation (perte d'eau dans les tissus) trop importante peut avoir des conséquences graves sur l'organisme.
IV. Introduction aux mélanges aqueux
1. Définitions
Solution : mélange liquide et homogène.
Solvant : liquide qui a la propriété de dissoudre ou de diluer des substances sans les modifier et sans se modifier lui-même.
Soluté : corps dissous par le solvant.
Solution saturée : solution qui ne peut plus dissoudre de soluté.
Solution insaturée : solution qui peut encore dissoudre du soluté.
Soluble : substance qui peut être dissoute.
Insoluble : substance qui ne peut pas être dissoute.
Miscible : deux liquides sont dits miscibles s'ils se mélangent totalement entre eux.
2. Un exemple de solvant : l'eau
L'eau, non toxique, est le solvant le plus courant car il permet de dissoudre un grand nombre de composés chimiques.
Les définitions données ci-dessus vont être illustrées grâce à des exemples de mélanges avec l'eau comme solvant.
Expérience :
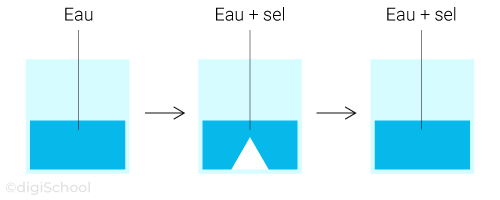
On remplit un petit bécher d'eau et on rajoute du sel. En mélangeant le contenu avec une cuillère, on remarque que le sel n'est plus visible.
Dans cette expérience, l'eau a dissous le sel. L'eau est le solvant et le sel est le soluté.
Observation :
Le mélange est homogène, c'est donc une solution.
On dit aussi que le sel est soluble dans l'eau.
Définition :
La solubilité d'une espèce chimique est la masse maximale qu'on est en mesure de dissoudre dans un volume de solvant donné.
Remarques :
Si on rajoute une trop grande quantité de sel dans le bécher, on remarque que l'eau n'arrive plus à dissoudre tout le sel introduit. On dit alors que la solution est saturée en sel.
Il peut arriver que l'eau ne puisse pas dissoudre certains composés comme de la limaille de fer ou le sable par exemple. On dit que dans ce cas qu'ils sont non solubles dans l'eau. On utilise alors d'autres types de solvants tels que l'éther anhydre, l'alcool, etc.
Expérience :
On introduit de l'eau dans un bécher puis du sirop de grenadine.
Observations :
On remarque qu'il y a deux phases bien distinctes, le mélange semble hétérogène et le sirop de grenadine ne paraît pas miscible avec l'eau.
Cependant, si on mélange l'eau et la grenadine (à l'aide d'une cuillère par exemple), le mélange va s'homogénéiser. Finalement, le mélange obtenu est alors homogène et la grenadine est donc miscible avec l'eau. On a donc bien une solution.
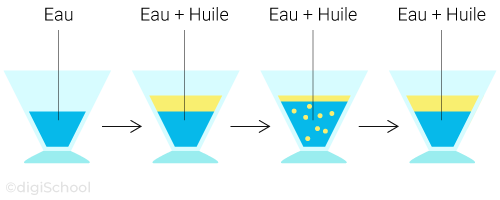
Expérience :
On introduit de l'eau dans un bécher puis de l'huile.
Observations :
Tout comme la grenadine, on remarque qu'il y a deux phases distinctes et le mélange semble hétérogène.
Faisons le même test qu'avec l'expérience précédente pour savoir si le mélange est réellement hétérogène : en mélangeant le contenu et en attendant un peu, on remarque que l'huile va remonter à la surface et redonner les deux phases distinctes du début. Le mélange obtenu est donc hétérogène et l'huile n'est pas miscible avec l'eau.
4. Test de la miscibilité pour les liquides
Pour savoir si deux liquides sont miscibles, ils sont introduits dans un bécher : le contenu est mélangé et est laissé au repos.
S'il ne reste qu'une seule phase alors le mélange est homogène et les deux liquides sont miscibles.
S'il reste deux phases alors le mélange est hétérogène et les deux liquides ne sont pas miscibles.
5. Conservation de la masse totale lors d'une dissolution
Comme vu précédemment, lors de la dissolution du sel dans de l'eau, le sel n'est plus visible après dissolution. Cependant, il n'a pas disparu comme il le laisserait croire. Pour montrer que la masse totale se conserve lors de la dissolution, il est possible d'effectuer une pesée avant et après dissolution.
Expérience :
On introduit d'eau dans un bécher et de sel. La pesée indique .
On mélange le contenu du bécher et l'eau dissout le sel.
Si on effectue une autre pesée, on verra que l'on a toujours une masse totale de , le sel est toujours présent même si on n'arrive pas à le voir.
Par une autre expérience, on peut mettre en évidence le fait que le sel n'a pas disparu.
Expérience :
Dans un tube à essai, on dissout du sel dans de l'eau. Le sel est alors devenu invisible.
Pour montrer que le sel n'a pas disparu, on chauffe le tube à essai pour que l'eau s'évapore.
Quand toute l'eau s'est évaporée, on remarque qu'il reste un résidu solide : c'est le sel initialement introduit.
Conclusion : même si le sel est invisible quand il est dissous, il ne disparaît pas pour autant !
V. Le pH de l'eau
1. Notion de
Le potentiel hydrogène, noté , est une grandeur qui permet de mesurer l'acidité ou la basicité d'une solution.
L'échelle de s'étend de à :
Une solution est acide si son est inférieur à ;
Une solution est neutre si son est égal à ;
Une solution est basique si son pH est supérieur à .
Exemple d'application : l'eau pure a un de , elle est donc neutre.
2. Mesure du
Le d'une solution peut être mesuré à l'aide de différents indicateurs ou instruments.
Le papier change de couleur en fonction du de la solution.
Les pH-mètres sont des instruments électroniques qui mesurent précisément le d'une solution.
Exemple d'application : pour mesurer le d'une solution, on peut tremper une bande de papier pH dans la solution et comparer la couleur obtenue avec l'échelle de couleurs fournie.
= Merci à Skops pour avoir contribué à l'élaboration de cette fiche =