I. Les états physiques et le cycle de l'eau
1. Rappels
Les états physique et le cycle de l'eau ont été introduits dans la fiche de cours suivante :
Pour rappel, l'eau existe sous trois états physiques : solide (glace), liquide (eau), gaz (vapeur d'eau).
Dans son cycle, l'eau peut-être observée naturellement sous différentes formes : neige, grêle (solide), ou encore pluie, givre, brouillard, buée (liquide).
Les changements d'états sont réversibles.
2. Comment se forment les nuages ?
Tout d'abord, un nuage n'est pas constitué de vapeur d'eau mais de fines gouttelettes d'eau et de cristaux de glace ; en effet, la vapeur d'eau est invisible.
Pour qu'il y ait formation d'un nuage, il faut tout d'abord qu'il y ait de l'air humide au sol. Cet air humide est soulevé en altitude : il va donc aller de plus en plus haut, tout en gardant la même quantité de vapeur d'eau.
À une certaine altitude, cet air humide va atteindre un seuil où la quantité de vapeur qu'il contient sera maximale (il ne pourra pas en contenir plus) : l'air est saturé en vapeur d'eau. La vapeur d'eau qui ne pourra pas être contenue dans l'air va se liquéfier autour des noyaux de condensation (fines particules de poussières invisibles) et va permettre la formation des nuages de gouttelettes d'eau.
En augmentant encore son altitude, la vapeur d'eau et les gouttelettes vont s'agglomérer autour des noyaux de congélation et va permettre la formation des nuages de cristaux de glace.
II. Propriétés des états physiques
La matière est constituée de molécules, elles-mêmes constituées d'atomes. La différence d'assemblage des molécules dans la matière permet d'expliquer la présence de ces trois états.
Comment sont assemblées les molécules pour chaque état ? Quelles sont les propriétés de ces états ?
Définition :
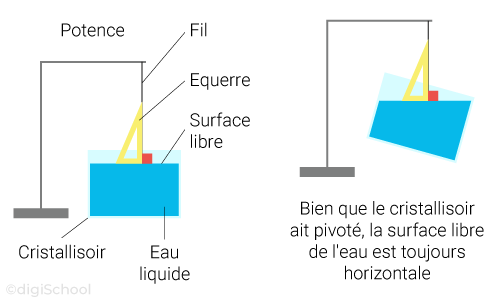
Surface libre : surface en contact avec l'air.
1. L'état solide
Assemblage : les molécules sont en contact entre elles et sont extrêmement resserrées (on peut considérer qu'elles sont "attachées" entre elles). Cela donne donc un état compact et ordonné.
Propriétés :
Un solide peut être pris totalement ou partiellement dans la main. Un solide que l'on pourra prendre dans sa main totalement sera appelé solide compact (glace) et un solide dont on ne pourrait prendre qu'une petite quantité sera appelé solide divisé (sable).
Les solides compacts ont une forme propre tandis que les solides divisés prennent la forme du récipient dans lequel ils sont mais ont une surface libre quelconque.
Illustration :
2. L'état liquide
Assemblage : les molécules sont en contact entre elles (mais ne sont pas "attachées"), elles glissent les unes sur les autres : c'est un état compact et désordonné.
Propriétés : les liquides n'ont pas de forme propre car ils prennent la forme du récipient qui les contient.
Illustration :
3. L'état gazeux
Assemblage : les molécules ne se touchent pas. Entre les molécules, il y a du vide, c'est-à-dire absence de matière. Les molécules sont en perpétuelle agitation.
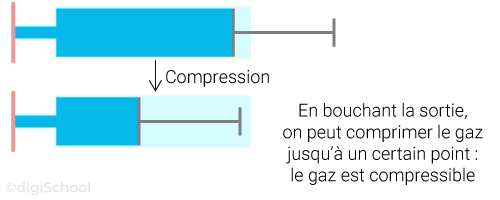
Propriétés : les gaz n'ont pas de forme propre. Ils sont cependant très compressibles et expansibles.
Définitions :
Compressibilité : caractéristique d'un corps à pouvoir réduire son volume sous une pression donnée ;
Expansibilité : caractéristique d'un corps à pouvoir occuper l'espace qui lui est attribué.
Illustration : utilisation d'une seringue.
III. Les changements d'états de l'eau
Les changements d'état de l'eau ont été introduits dans la fiche de cours suivante :
Chaque changement d'état (= passage d'un état physique à un autre) porte un nom qui lui est propre :
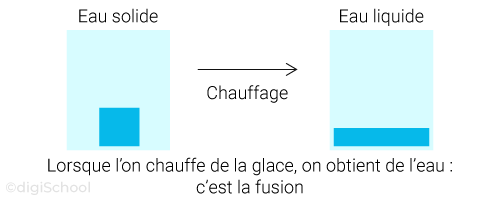
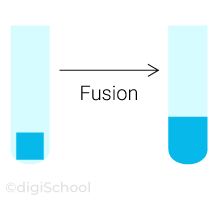
Le passage de l'état solide à l'état liquide est appelé la fusion ;
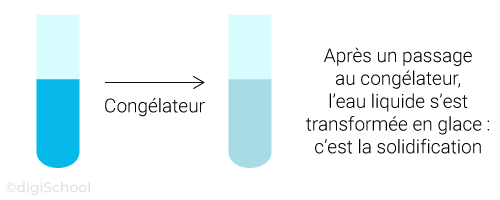
Le passage de l'état liquide à l'état solide est à contrario appelé la solidification ;
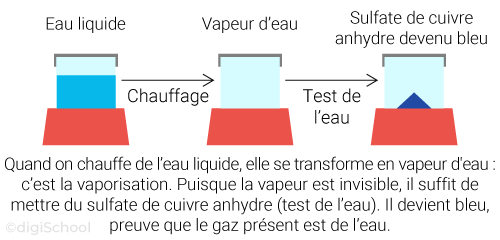
Le passage de l'état liquide à l'état gazeux est appelé l’évaporation ;
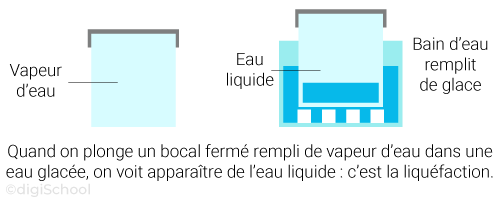
Le passage de l'état gazeux à l'état liquide est à contrario appelé la liquéfaction (souvent désignée abusivement par "condensation") ;
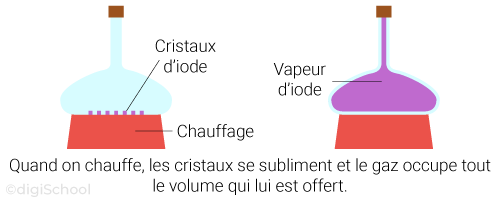
Le passage de l'état gazeux à l'état solide est appelé la condensation ;
Le passage de l'état solide à l'état gazeux est à contrario appelé la sublimation.
En synthèse :
Remarques : il n'est pas possible d'observer les phénomènes de condensation et de sublimation à pression ambiante avec l'eau. Il est cependant possible de le faire avec l'iode.
IV. Masse et volume
Les notions de masse et volume (unité, conversion et mesure) ont été introduits dans la fiche de cours suivante :
Remarque : il est possible d'établir en travaux pratiques une relation de proportionnalité entre la masse et le volume d’un corps homogène. Cette notion, appelée masse volumique, sera vue plus en détail en classe de 4e.
V. Conservation de la masse et variation de volume lors des changements d'états
1. Propriété des changements d'états et particularité de l'eau
Comme cela a été vu au §II, lors d'un changement d'état, les molécules s'éloignent ou se rapprochent (d'où la variation de volume) mais n'augmentent pas et ne se réduisent pas.
On pourrait penser que si le volume augmente, la masse augmente mais lorsque les molécules s'éloignent, il y a uniquement du vide entre elles et le vide a une masse nulle.
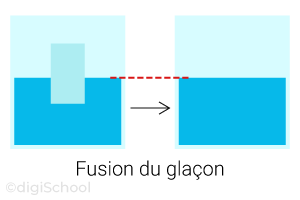
Une expérience simple permet de constater ce phénomène : la fusion d'un glaçon.
Mettons un glaçon (de masse ) ayant la forme d'un cube de côté dans une éprouvette et attendons sa fusion.
Le glaçon a donc un volume de .
Après la fusion, on peut lire sur la graduation de l'éprouvette . Si on pèse le liquide, on trouvera une masse de .
On a vu que lorsqu'un liquide se solidifiait, les molécules se rapprochaient et s'attachaient entre elles (le volume diminue donc). Il est donc assez particulier de voir que l'eau - en se solidifiant - augmente de volume. C'est une particularité de certains composés. Dans le cas de l'eau, en se solidifiant, ses molécules adoptent une disposition spéciale qui explique l'augmentation du volume. Le sodium, l'argent et le bismuth possèdent également cette particularité.
Propriété : au cours d'un changement d'état, il y a variation de volume et conservation de la masse.
2. La fonte des icebergs et des glaciers ferait-elle augmenter le niveau de l'eau ?
Illustration : expérience du glaçon dans l'eau. Lors de la fusion du glaçon, la hauteur de l'eau ne varie pas, étrange non ?
Il faut savoir que pour la glace, seule du glaçon émerge de l'eau et reste en-dessous. Quand l'eau passe de l'état solide à l'état liquide, son volume diminue de . Quand on met le glaçon dans le verre, le volume de l'eau augmente de du volume du glaçon. Ensuite, il y a fusion et on s'attendrait plutôt à voir une augmentation de la hauteur (le volume des du glaçon immergé qui est passé à l'état liquide remplacerait le volume des du glaçon solide et les restant contribueraient à faire augmenter la hauteur). Mais la fonte du glaçon s'accompagne d'une diminution de de son volume donc les du glaçon qui contribueraient à faire augmenter la hauteur sont compensés par cette diminution de volume. La fonte des icebergs ne ferait pas augmenter le niveau de la mer. Les glaciers par contre ne sont pas situés dans l'eau et dans ce cas la hauteur augmenterait. (C'est comme si on avait un glaçon en dehors de l'eau que l'on mettrait dans un verre d'eau, il y aurait évidemment une variation de la hauteur).
Remarque : cette expérience fonctionne seulement si le solide et le liquide sont le même composé.
3. Pourquoi les canalisations d'eau éclatent par grand froid ?
Illustration : expérience de la bouteille d'eau dans le congélateur. Lorsque l'on place une bouteille d'eau remplie au congélateur, la bouteille explose.
Ceci s'explique tout simplement par l'augmentation du volume de l'eau pendant sa solidification. Son volume augmente et la bouteille, ne pouvant pas contenir ce volume, explose.
L'explication est la même pour les canalisations gelées, le volume grandit en se solidifiant et la canalisation explose.
Le même problème se pose lors du moulage de l'argent (qui possède cette même propriété que l'eau).
VI. La température
1. Température d'un corps
La température sert à caractériser l'état d'un corps.
L'unité communément utilisée pour mesurer une température est le degré Celsius (noté ). Il existe plusieurs autres échelles de température : le degré Fahrenheit (, mesure anglo-saxonne) et le Kelvin (, unité du système international).
Le de l'échelle Celsius est la température à laquelle l'eau se solidifie.
Le de l'échelle Fahrenheit est la température la plus basse qu'ait observée Fahrenheit pendant l'hiver de 1708-1709.
Le de l'échelle Kelvin est la température la plus basse possible. On parle du 0 absolu.
Pour mesurer la température, on utilise un thermomètre que l'on plonge là où on veut connaître la température.
2. Variation de la température lors d'un changement d'état
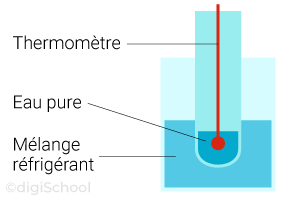
Expérience : soit un mélange réfrigérant (1/3 sel, 2/3 glace). Un tube à essai contenant 5 mL d'eau pure est plongé avec un thermomètre inséré pour suivre suivi de l'évolution de la température au cours du temps.
Résultat :
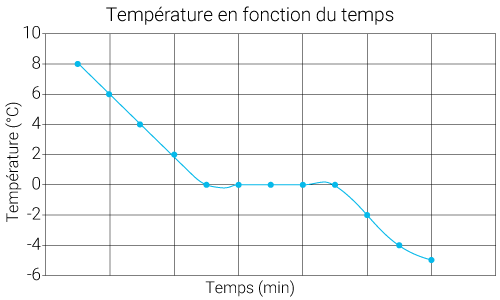
Voici le graphique obtenu de l'évolution de la température du tube à essai en fonction du temps.
On remarque que lors de la solidification à , la température reste constante. On dit qu'il y a existence d'un palier de température.
Palier de changement d'état :
Lors d'un changement d'état d'un corps pur, la température reste constante.
Ce palier de température est généralisable à tous les changements d'états pour un corps pur.
Remarque : en refaisant l'expérience avec de l'eau salée, on obtiendrait le graphique ci-dessous. On s'aperçoit qu'il n'y a pas de palier de température car c'est un mélange et l'eau salée ne se solidifie pas à mais à . C'est d'ailleurs pour cette raison que l'on verse du sel sur le verglas en hiver pour qu'il y ait fusion.
VII. Variation de la température d'ébullition avec la pression
Dans toutes les expériences effectuées jusqu'à présent, ces dernières étaient réalisées à pression ambiante. Est-ce que l'eau se vaporise à quelle que soit la pression ?
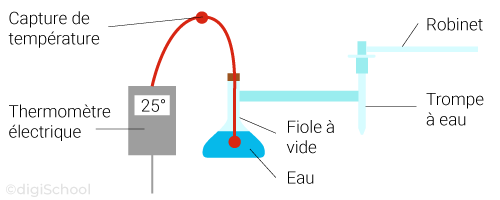
Expérience : ébullition de l'eau à pression réduite.
On s'aperçoit que l'eau entre en ébullition à température ambiante, incroyable non ?
La température d'ébullition varie en fonction de la pression. Nous sommes habitués à voir une ébullition à parce que nous la faisons à chaque fois à pression ambiante.
Propriété :
Si la pression augmente, la température d'ébullition augmente ;
Si la pression diminue, la température d'ébullition diminue.
Pourquoi une cocotte-minute fait-elle cuire les aliments plus rapidement qu'une casserole ?
La cocotte-minute est une enceinte hermétiquement close qui contient toute la vapeur d'eau. Cette vapeur d'eau crée une surpression et de ce fait, la pression est supérieure à la pression atmosphérique et la température d'ébullition va s'en trouver augmentée.
L'eau liquide pourra donc atteindre une température nettement plus élevée sans vaporisation (de l'ordre de ).
= Merci à Skops pour avoir contribué à l'élaboration de cette fiche =