I. Évolution de l'Univers
1. Formation de l'Univers
L'évolution de l'Univers est un sujet fascinant qui permet de comprendre comment la matière s'est organisée depuis le Big Bang jusqu'à aujourd'hui.
Le Big Bang, il y a environ 13,8 milliards d'années, marque le début de l'expansion de l'Univers. À partir de cet événement, l'Univers a commencé à se refroidir et à se structurer.
Les premières particules subatomiques, comme les protons et les neutrons, se sont formées dans les premières minutes qui ont suivi le Big Bang. Ces particules ont ensuite formé les noyaux des premiers atomes, principalement de l'hydrogène et de l'hélium.
Environ 380 000 ans après le Big Bang, les électrons ont pu se lier aux noyaux pour former les premiers atomes neutres, permettant à la lumière de se propager librement. C'est ce qu'on appelle le fond diffus cosmologique.
Des millions d'années plus tard, sous l'effet de la gravité, les régions plus denses de l'Univers ont commencé à attirer plus de matière, formant ainsi les premières étoiles et galaxies.
2. Composition des étoiles et des galaxies
Les étoiles sont des usines cosmiques où les éléments plus lourds que l'hydrogène et l'hélium sont synthétisés. Ce processus, appelé nucléosynthèse stellaire, produit des éléments comme le carbone, l'oxygène, le silicium et le fer, qui sont essentiels à la formation des planètes et de la vie.
La matière constituant la Terre et les étoiles est donc le résultat de ces processus cosmiques. Les éléments lourds, comme le fer et le silicium, se sont formés dans les étoiles et ont été dispersés dans l'Univers par les explosions de supernovæ.
Les planètes se forment à partir de la matière présente dans les disques protoplanétaires autour des jeunes étoiles. Les planètes rocheuses (ou telluriques), comme la Terre, sont principalement composées d'éléments lourds, tandis que les planètes gazeuses contiennent plus d'éléments légers comme l'hydrogène et l'hélium.
La classification périodique des éléments, qui organise les éléments chimiques en fonction de leur nombre de protons, est un outil précieux pour comprendre la composition de la matière dans l'Univers.
3. Lois régissant l'Univers
La loi de la gravitation universelle, formulée par Isaac Newton, explique comment les objets massifs, comme les planètes et les étoiles, interagissent entre eux. Cette loi est essentielle pour comprendre les mouvements des corps célestes et la structure de l'Univers :
La loi de gravitation universelle
La matière observable dans l'Univers est partout de même nature et obéit aux mêmes lois physiques. Cela signifie que les lois de la physique que nous observons sur Terre s'appliquent également aux objets les plus éloignés de l'Univers.
La notion d'année-lumière est cruciale pour mesurer les distances astronomiques. Pour rappel, une année-lumière est la distance que la lumière parcourt en une année, soit environ 9,461 milliards de kilomètres. Cela permet de comparer les distances dans notre système solaire et au-delà. Cette notion a été introduite en 4e dans la fiche suivante (§II. 2. b.) :
Conditions et vitesses de propagation du son et de la lumière
L'expression « voir loin, c'est voir dans le passé » est particulièrement pertinente en astronomie. En effet, en regardant des objets éloignés dans l'Univers, nous voyons la lumière qui a été émise il y a longtemps, nous donnant ainsi un aperçu du passé de l'Univers.
II. Structure d'un atome
1. Un peu d'histoire
Dès 420 avant J.C., Démocrite (philosophe grec) a l'intuition de l'existence des atomes et invente leur nom (« atomos » en grec qui signifie insécable). Ceux-ci sont très petits, de différentes formes (ronds ou crochus, lisses ou rugueux) et s'associent pour former les objets qui nous entourent.
Aristote (philosophe grec) conteste cette existence et son prestige est tel qu'il faut attendre le début du XIXe siècle pour que cette idée reprenne vie.
En 1805, John Dalton annonce au monde l'existence des atomes.
En 1881, Thomson découvre l'un des composants de l'atome. Il s'agit de particules élémentaires négatives appelées en 1891 électrons.
Au début du XXe siècle, l'ambition des physiciens est de proposer un modèle de l'atome en précisant la répartition de la charge électrique à l'intérieur de celui-ci.
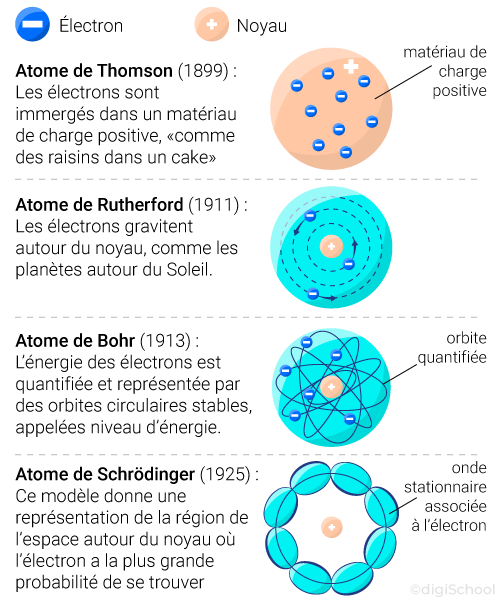
En 1904, Thomson, partant de l'idée que l'atome est électriquement neutre, pense qu'il doit contenir des charges positives qui doivent compenser les charges négatives des électrons. Il suppose que la charge positive est répartie dans un petit volume (qui peut avoir la forme d'une sphère) et qu'elle est parsemée d'électrons (pudding de Thomson).
En 1910, Rutherford bombarde différents échantillons de matière (cuivre, or, argent) avec des particules et il déduit de son expérience que la charge positive doit occuper un tout petit volume qu'il appelle « noyau ». Après « un petit calcul », il trouve que la majorité de la masse de l'atome est concentrée dans un noyau minuscule. Les dimensions du noyau sont de l'ordre de ( fois moins que les dimensions de l'atome) et sa charge totale est un multiple entier de la charge de l'électron (au signe près).
Rutherford pense alors au modèle planétaire pour décrire un atome. En effet, la masse du système solaire est essentiellement concentrée dans le Soleil tout comme celle de l'atome est concentrée dans le noyau. Il propose donc comme modèle un tout petit noyau chargé positivement et comportant l'essentiel de la masse de l'atome, autour duquel les électrons décrivent des orbites.
En 1913, Niels Bohr (1885-1962) propose un nouveau modèle d'atome : les orbites des électrons ne sont pas quelconques mais "quantifiées" ; seules certaines orbites particulières sont permises pour l'électron. Ce n'est que lorsque celui-ci saute d'une orbite à l'autre qu'il peut émettre (ou absorber) de la lumière.
Depuis, d'autres modèles plus complexes ont été élaborés, non plus sur la base de la physique classique mais sur la base de la physique quantique ! En effet, s'inspirant des travaux du physicien français Louis de Broglie, Erwin Schrödinger (1887-1961), propose un nouveau modèle de l'atome dans lequel les électrons ne décrivent plus des orbites mais sont contenus dans un nuage électronique, zone de forte probabilité de présence (ou "orbitales"). C'est le modèle actuel de l'atome.
2. Modèle retenu pour l'atome
Schéma bilan de l'évolution des modèles de l'atome (d'après blog.univ-angers.fr) :
Le modèle de l'atome qui sera considéré est celui d'un noyau central autour duquel gravitent des électrons constituant un nuage électronique.
III. Les atomes et les molécules
Les atomes sont les constituants de la matière. Ce sont des particules extrêmement petites car leur dimension est de l'ordre du dixième de nanomètre (, soit 1 milliardième de m).
Il a été vu qu'un atome est constitué d'un noyau central autour duquel gravitent des électrons constituant un nuage électronique :
Les électrons :
Chaque électron porte une seule charge négative.
Ils sont tous identiques.
Ils forment le nuage électronique.
Ils ont une masse très faible (négligeable).
Ils donnent sa taille à l'atome.
Le noyau :
Contient des particules de charge positive (protons) ainsi que des particules électriquement neutres (les neutrons) ; les protons et neutrons constituent ce qu'on appelle les nucléons.
Le numéro atomique (ou nombre de charges) , constitue le nombre de protons.
Contient presque toute la masse de l'atome.
Est fois plus petit que l'atome.
L'atome est électriquement neutre : le nombre de charges positives du noyau est donc égal au nombre de charges négatives des électrons.
Il y a donc autant de protons que d'électrons dans un atome.
Un atome est essentiellement constitué de vide : on dit qu'il a une structure lacunaire.
IV. Le courant électrique dans un métal
1. Les solides conducteurs
Expérience :
On réalise le montage suivant en intercalant différents matériaux dans le circuit.
Si la lampe s'éclaire, le matériau est conducteur de l'électricité.
Si elle reste éteinte, c'est un isolant électrique.
Cette expérience nous prouve que tous les solides ne conduisent pas le courant électrique.
Par contre, tous les métaux sont des conducteurs électriques.
2. Pourquoi les métaux conduisent le courant ?
Un microscope à effet tunnel montre que les métaux sont constitués d'atomes rangés de façon ordonnée.
Dans ces atomes, la plupart des électrons sont solidement liés au noyau. Cependant, certains électrons peuvent se déplacer d'un atome à l'autre avec facilité. Ce sont des électrons libres.
Dans un métal, le courant électrique est donc dû à la circulation d'électrons libres.
3. Sens de déplacement des électrons
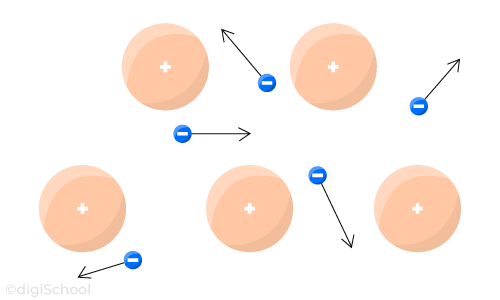
En l'absence de générateur (= absence de tension électrique), le mouvement des électrons libres est incessant et désordonné :
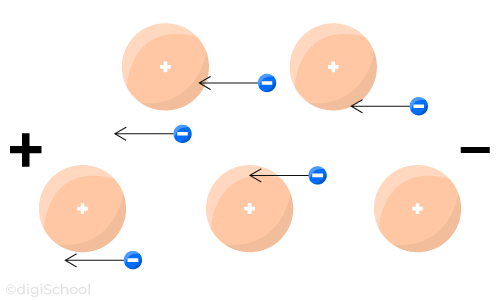
Avec une tension électrique appliquée aux extrémités :
Le générateur du circuit attire les électrons vers le pôle .
Le générateur provoque un mouvement d'ensemble des électrons libres vers la borne positive du générateur.
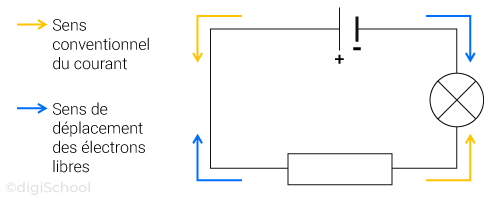
Rappel : à l'extérieur du générateur, le sens conventionnel du courant est dirigé de la borne vers la borne .
Conclusion : les électrons libres se déplacent donc dans le sens opposé au sens conventionnel du courant.
Remarque : les isolants n'ont pas d'électrons libres.