I. Rappels : les atomes et les molécules
La matière est constituée de particules fondamentales appelées atomes. Les atomes peuvent se lier pour former des molécules :
Atomes : ce sont les constituants élémentaires de la matière.
Molécules : elles sont formées par la combinaison de deux ou plusieurs atomes liés chimiquement.
Exemples d'application :
L'eau () est une molécule composée de atomes d'hydrogène et d' atome d'oxygène ;
Le dioxyde de carbone () est une molécule composée d' atome de carbone et de atomes d'oxygène.
II. Rappels : les états de la matière
La matière peut exister sous différents états : solide, liquide et gazeux. Chaque état a des propriétés spécifiques :
Solide : les solides ont une forme et un volume définis. Les particules sont étroitement liées et vibrent autour de positions fixes ;
Liquide : les liquides ont un volume défini mais prennent la forme du récipient qui les contient. Les particules sont proches mais peuvent se déplacer les unes par rapport aux autres ;
Gazeux : les gaz n'ont ni forme ni volume définis. Les particules sont éloignées les unes des autres et se déplacent librement.
Exemple d'application : l'eau peut exister sous forme de glace (solide), d'eau liquide et de vapeur (gaz).
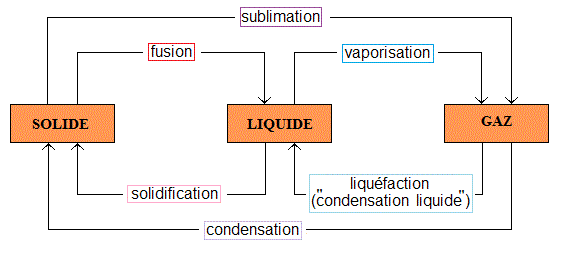
III. Rappels : les changements d'état, une transformation physique
Les changements d'état de la matière sont des processus physiques où la matière passe d'un état à un autre sans changer sa composition chimique :
Fusion : passage de l'état solide à l'état liquide ;
Solidification : passage de l'état liquide à l'état solide ;
Vaporisation : passage de l'état liquide à l'état gazeux ;
Liquéfaction : passage de l'état gazeux à l'état liquide ;
Sublimation : passage de l'état solide à l'état gazeux sans passer par l'état liquide ;
Condensation : passage de l'état gazeux à l'état solide sans passer par l'état liquide.
Exemple d'application : la glace fond pour devenir de l'eau liquide (fusion) et l'eau bout pour devenir de la vapeur (vaporisation).
IV. Masse volumique
La masse volumique est une propriété physique qui permet de caractériser la matière. Elle est définie comme la masse d'une substance par unité de volume.
La relation à connaître pour calculer la masse volumique est :
où :
est la masse volumique (en ou ),
est la masse de l'échantillon (en ou ),
est le volume de l'échantillon (en ou ).
Exemples de masses volumiques :
;
;
;
.
Remarque : calculer la masse volumique d'un échantillon de métal permet de déterminer sa nature et ses propriétés physiques.
V. Utilisation des métaux dans la vie quotidienne
1. Les métaux les plus fréquemment utilisés
Les métaux sont largement utilisés dans notre vie quotidienne en raison de leurs propriétés uniques.
Dans la nature, ils se trouvent trouvent sous forme de minerai. Ils sont ensuite travaillés pour leur donner les formes connues actuellement :
Fer : c'est le métal le plus utilisé dans le monde. Il est souvent utilisé sous forme d'alliages pour améliorer ses propriétés ;
Cuivre : c'est un excellent conducteur électrique et est utilisé dans les câbles électriques et les composants électroniques ;
Aluminium : il est léger et résistant à la corrosion, ce qui le rend idéal pour les applications dans les transports et l'emballage ;
Zinc : il est utilisé pour protéger le fer de la corrosion par galvanisation ;
Or et argent : ils sont utilisés notamment pour la confection de bijoux.
Exemple d'application : les canettes de soda en aluminium peuvent être recyclées pour fabriquer de nouveaux produits, réduisant ainsi les déchets et économisant les ressources naturelles.
Remarque : lorsqu'on mélange à haute température un métal avec un ou plusieurs éléments, on obtient un alliage. Quelques exemples d'alliages : bronze (cuivre et étain), laiton (cuivre et zinc) ou encore acier (fer et carbone).
2. Reconnaissance des principaux métaux
Comme il a été vu précédemment, il est possible de calculer la masse volumique d'un échantillon de métal pour en déterminer sa nature, et donc ses propriétés physiques.
Un métal peut également être reconnu grâce à sa couleur :
Lorsqu'un métal est en contact avec le dioxygène de l'air, il se produit une oxydation. Il se forme un oxyde métallique.
En s'oxydant, les métaux changent généralement de couleur :
Remarques :
Certains métaux s'oxydent difficilement ;
L'oxyde de cuivre est autrement appelé vert de gris. L'oxyde de fer est la rouille et l'oxyde d'aluminium est l'alumine.
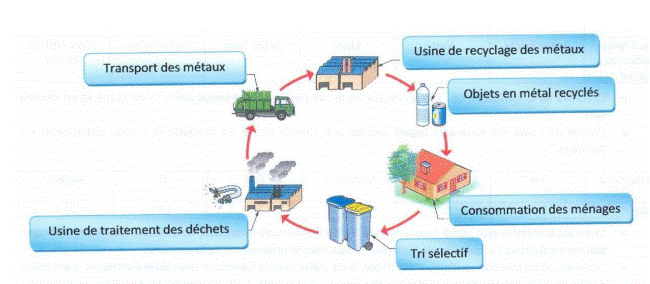
VI. Application : le tri sélectif
Le tri sélectif est une pratique importante pour la gestion des déchets. Il permet de collecter, trier et recycler les matériaux pour leur donner une seconde vie.
Collecte : les métaux sont collectés séparément des autres déchets ;
Tri : les métaux sont triés selon leur nature et leurs propriétés ;
Recyclage : les métaux triés sont fondus et transformés en nouveaux produits.
Exemple : les canettes de soda en aluminium peuvent être recyclées pour fabriquer de nouvelles canettes ou d'autres produits en aluminium.