I. Les ions
1. Définition
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électron(s).
L'atome ou groupe d'atomes qui perd un ou des électron(s) devient un ion positif appelé cation.
L'atome ou groupe d'atomes qui gagne un ou des électron(s) devient un ion négatif appelé anion.
2. Les ions monoatomiques
Les ions monoatomiques ne sont formés que par seul type d'atome.
Exemple 1 : l'ion sodium
L'ion sodium correspond à un atome de sodium ayant perdu électron ;
L'atome de sodium () est constitué de protons et de électrons (charge totale est nulle) ;
L'ion sodium est composé de protons () et de électrons () ;
;
On notera l'ion sodium : .
Exemple 2 : l'ion chlorure
L'ion chlorure est un atome de chlore qui a gagné électron ;
L'atome de chlore () est constitué de protons et de électrons (charge totale est nulle) ;
L'ion chlorure est composé de 17 protons () et de 18 électrons () ;
;
On notera l'ion chlorure : .
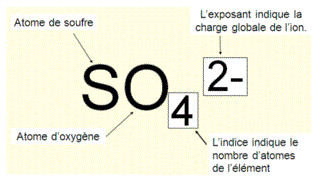
3. Les ions polyatomiques
Les ions polyatomiques sont formés par un groupement de plusieurs atomes.
La charge positive ou négative s'applique à l'ensemble des atomes du groupe.
Exemple : ion sulfate
II. Les principaux ions rencontrés
1. Les ions positifs ou cations
Ions monoatomiques positifs :
Ions polyatomiques positifs :
L'ion ammonium .
2. Les ions négatifs ou anions
Ions monoatomiques négatifs :
Ions polyatomiques négatifs :
 III. Tests de reconnaissance des principaux ions
III. Tests de reconnaissance des principaux ions
Cette liste n'est pas exhaustive. Elle peut donc être complétée.
1. L'ion chlorure
On utilise une solution de nitrate d'argent .
L'ion réagit avec l'ion pour former le précipité chlorure d'argent .
L'équation de la réaction est .
Remarque : c'est un précipité qui noircit à la lumière.
2. L'ion magnésium
On utilise une solution d'hydroxyde de sodium .
L'ion réagit avec l'ion pour former le précipité hydroxyde de magnésium .
L'équation de la réaction est .
Remarque : c'est un précipité blanc.
3. Ion sodium
On fait un test de flamme : la flamme est jaune orangée.
4. Ion potassium
On fait un test de flamme : la flamme est violette.
5. Ion sulfate
On utilise une solution de chlorure de baryum .
L'ion SO réagit avec l'ion Ba pour former le précipité sulfate de baryum .
L'équation de la réaction est .
Remarque : c'est un précipité blanc.
6. L'ion cuivre (II)
On utilise une solution d'hydroxyde de sodium .
L'ion réagit avec l'ion pour former le précipité hydroxyde de cuivre (II) .
L'équation de la réaction est .
Remarque : c'est un précipité bleu.
7. L'ion fer (II)
On utilise une solution d'hydroxyde de sodium .
L'ion réagit avec l'ion pour former le précipité hydroxyde de fer (II) .
L'équation de la réaction est .
Remarque : c'est un précipité verdâtre.
8. L'ion fer (III)
On utilise une solution d'hydroxyde de sodium .
L'ion réagit avec l'ion pour former le précipité hydroxyde de fer (III) .
L'équation de la réaction est .
Remarque : c'est un précipité rouille.
9. L'ion zinc
On utilise une solution d'hydroxyde de sodium .
L'ion réagit avec l'ion pour former le précipité hydroxyde de zinc .
L'équation de la réaction est .
Remarque : c'est un précipité blanc, soluble dans un excès de soude.
10. L'ion calcium
On utilise une solution d'oxalate d'ammonium .
L'ion réagit avec l'ion pour former le précipité oxalate de calcium .
L'équation de la réaction est .
Remarque : c'est un précipité blanc.
11. L'ion phosphate
On utilise une solution de nitrate d'argent .
L'ion réagit avec l'ion pour former le précipité phosphate d'argent .
L'équation de la réaction est .
Remarque : c'est un précipité jaunâtre.
IV. Identifier le caractère acide ou basique d'une solution par mesure de pH
1. Notion de (rappel de 5e)
Le potentiel hydrogène, noté , est une grandeur qui permet de mesurer l'acidité ou la basicité d'une solution.
L'échelle de s'étend de à :
Une solution est acide si son est inférieur à ;
Une solution est neutre si son est égal à ;
Une solution est basique si son pH est supérieur à .
Exemple d'application :
L'eau pure a un de , elle est donc neutre ;
Le jus de citron a un d'environ , il est donc acide ;
L'eau de Javel a un d'environ , elle est donc basique.
2. Mesure du
Le d'une solution peut être mesuré à l'aide de différents indicateurs ou instruments.
Le papier change de couleur en fonction du de la solution.
Les pH-mètres sont des instruments électroniques qui mesurent précisément le d'une solution.
Exemple d'application : pour mesurer le d'une solution, on peut tremper une bande de papier pH dans la solution et comparer la couleur obtenue avec l'échelle de couleurs fournie.
3. Ions responsables du caractère acide ou basique
Le caractère acide d'une solution est dû à la présence d'ions hydrogène, notés .
Le caractère basique d'une solution est dû à la présence d'ions hydroxyde, notés .
Dans une solution neutre, les quantités en ions et sont égales.
Propriétés :
Dans une solution acide, la quantité d'ions est supérieure à celle en ions ;
Dans une solution basique, la quantité d'ions est supérieure à celle en ions .
4. Applications pratiques
La mesure du est importante dans de nombreux domaines, comme la chimie, la biologie, l'environnement et l'industrie.
En agriculture, le du sol est mesuré pour déterminer les besoins en amendements et en engrais. En effet, pour cultiver des plantes, il est important de connaître le du sol, car certaines plantes préfèrent les sols acides, tandis que d'autres préfèrent les sols basiques.
Dans le traitement de l'eau, le est contrôlé pour garantir la qualité de l'eau potable et des eaux usées.
V. Le courant électrique dans les solutions
Les propriétés associées aux solutions ioniques sont abordées dans la fiche de cours suivante :
L'énergie chimique et électrochimique
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =