I. Le courant électrique dans les solutions
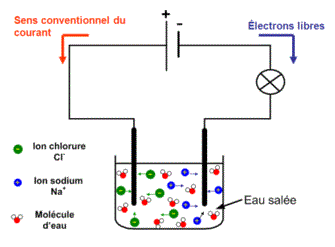
1. Les solutions ioniques sont conductrices
L'eau pure, l'eau sucrée ou l'huile contiennent des molécules : ce ne sont pas des solutions conductrices.
En revanche, les solutions qui contiennent des ions (solutions ioniques) sont conductrices.
Exemple : eau salée, solution de sulfate de cuivre, vinaigre, soude, etc.
Conclusion : les solutions aqueuses doivent contenir des ions (particules chargées) pour être conductrices. Les solutions qui ne contiennent que des molécules ne sont pas conductrices.
2. Nature d'une solution ionique
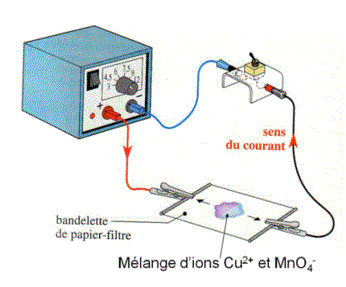
On réalise l'expérience suivante :
Les ions cuivre , de couleur bleue, se sont déplacés dans le sens du courant, vers la borne du générateur.
Les ions permanganate , de couleur violette, se sont déplacés dans le sens opposé à celui du courant, vers la borne .
Conclusion :
Dans les solutions aqueuses, le courant électrique est dû à un déplacement d'ions.
Les ions positifs (= cations) se déplacent dans le sens du courant (vers la borne ) et les ions négatifs (=anions) dans le sens contraire (vers la borne ).
3. Schéma récapitulatif
II. Une réaction chimique produit de l'énergie
Expérience :
On introduit une solution de sulfate de cuivre dans un tube à essai et on relève la température ;
Puis, on introduit dans ce tube de la poudre de zinc () et on agite. On relève de nouveau la température.
Observations :
La couleur bleue disparaît ;
Un dépôt rougeâtre se forme sur la poudre de zinc ;
La température de la solution augmente.
Interprétation :
Des ions cuivre (II) - - ont été consommés ;
Du métal cuivre - - s'est formé ;
Des ions zinc (II) - - se sont formés car si on ajoute de la soude (= solution d'hydroxyde de sodium) à la solution finale, il se forme un précipité blanc ;
La température augmente lors de la réaction, donc de l'énergie thermique est libérée.
Conclusion :
Le sulfate de cuivre réagit avec le zinc : l'ensemble des réactifs possède de l'énergie chimique ;
Lors de la transformation chimique, une partie de cette énergie est transférée à l'extérieur sous forme d'énergie thermique.
III. Fabrication et étude d'une pile
Expérience :
On plonge deux lames métalliques (électrodes), l'une en cuivre et l'autre en zinc, dans un bécher contenant une solution de sulfate de cuivre ;
On relie les deux électrodes à un voltmètre ;
On mesure ensuite l'intensité du courant débité par la pile, après avoir inséré une résistance dans le circuit.
Observation :
Le voltmètre indique une tension d'environ lorsque sa borne est reliée à l'électrode de cuivre ;
L'ampèremètre indique une intensité d'environ ;
L'électrode de zinc est rongée et du métal cuivre se dépose sur l'électrode de cuivre ;
La solution se décolore.
Interprétation :
L'électrode de cuivre constitue l'électrode positive de la pile et l'électrode de zinc constitue la borne négative ;
La pile s'use :
Du métal zinc disparaît et des ions Zn apparaissent ;
Des ions Cu disparaissent et du métal cuivre se dépose sur l'électrode de cuivre.
Conclusion :
Une pile électrochimique est constituée de deux électrodes de natures différentes, généralement métalliques, plongeant dans une solution conductrice ;
Lorsque la pile fonctionne, il se produit une transformation chimique (celle du paragraphe précédent) ;
Une partie de l'énergie chimique des réactifs est convertie en énergie électrique et une autre partie est transférée à l'extérieur sous forme d'énergie thermique ;
La consommation des réactifs entraîne « l'usure » de la pile.