I. Composition de l'acide chlorhydrique
1. Tests de reconnaissance des principaux ions (rappels)
Les principaux tests de reconnaissance des ions ont été introduits dans la fiche de cours suivante :
Les ions et leur identification
2. Protocole expérimental
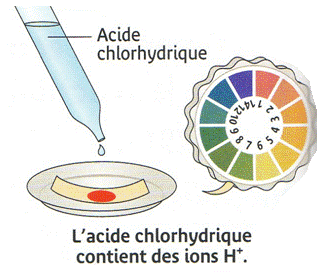
Description : on verse de l'acide chlorhydrique dans un bécher et on mesure son pH
Observation : la valeur du est égale à .
Interprétation : le de cette solution est acide, cela signifie donc que l'acide chlorhydrique contient des ions .
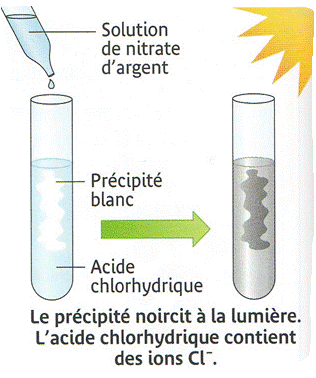
Description : on verse quelques gouttes de solution de nitrate d'argent dans de l'acide chlorhydrique.
Observation : on observe la formation d'un précipité blanc qui noircit à la lumière.
Interprétation : ce précipité prouve la présence d'ions chlorure dans l'acide chlorhydrique.
L'acide chlorhydrique contient des ions hydrogène et des ions chlorure en solution dans l'eau.
La formule ionique de la solution d'acide chlorhydrique est .
II. Réactions entre solutions acides et basiques
Une réaction entre une solution acide et une solution basique est appelée réaction de neutralisation.
Lors de cette réaction, les ions hydrogène de l'acide réagissent avec les ions hydroxyde de la base pour former de l'eau.
L'équation de réaction chimique générale pour une réaction de neutralisation est :
Exemple d'application :
Si on mélange une solution d'acide chlorhydrique , avec une solution d'hydroxyde de sodium , , la réaction de neutralisation produit de l'eau et du chlorure de sodium (les ions et n'intervenant pas dans la transformation).
III. Réactions entre solutions acides et métaux
1. Protocole expérimental
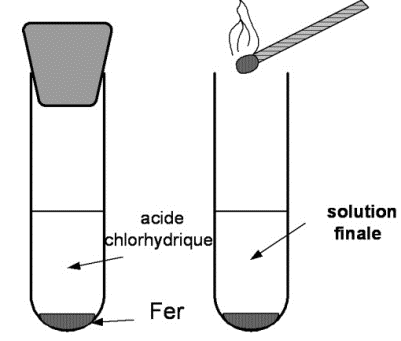
Mode opératoire :
Dans un tube à essais grand modèle, mettre environ pointes de spatule de fer en poudre ; puis ajouter d'acide chlorhydrique (environ ) et boucher.
Quand la pression est forte (le bouchon a tendance à remonter), approcher une flamme du tube débouché.
Observations :
Pendant la transformation chimique, on observe une vive effervescence.
En présentant la flamme, on entend « un pop » qui caractérise la présence du gaz dihydrogène.
On observe aussi la disparition d'une partie du fer et que le augmente au cours de cette réaction.
Conclusion :
Une transformation (ou réaction chimique) a eu lieu : le fer est un réactif alors que le dihydrogène est un produit.
2.Analyse de la solution après la réaction
On récupère la solution après filtration et on réalise deux tests :
Test à la soude (solution d'hydroxyde de sodium) : il se forme un précipité vert qui caractérise la présence d'ions fer (II) ().
Test au nitrate d'argent : il se forme un précipité blanc qui caractérise la présence d'ions chlorure ().
Interprétation : la solution obtenue qui contient des ions chlorure et des ions fer II est une solution de chlorure de fer (II).
Conclusion : on peut écrire le bilan suivant :
Fer + acide chlorhydrique dihydrogène + chlorure de fer (II)
Remarques :
Les ions chlorures sont présents en même quantité avant et après la réaction, donc ils ne participent pas à la transformation : ce sont des ions spectateurs.
Le a augmenté donc ce sont les ions qui ont disparu et réagi avec le fer.
On en déduit que les réactifs de cette transformation sont le fer et les ions hydrogène alors que les produits sont le dihydrogène et les ions fer (II).
On peut donc écrire un nouveau bilan :
Fer + ions hydrogène dihydrogène + ions fer (II)
L'équation-bilan de la réaction du fer avec l'acide chlorhydrique s'écrit :
IV. Distinction entre transformation chimique, mélange et transformation physique
Une transformation (ou réaction) chimique est un processus au cours duquel les substances initiales (réactifs) sont converties en nouvelles substances (produits) avec des propriétés différentes.
Un mélange est une combinaison de substances où chaque substance conserve ses propriétés chimiques.
Une transformation physique est un processus au cours duquel la matière change d'état ou de forme sans que sa composition chimique ne soit modifiée.
Exemples :
L'action de l'acide chlorhydrique sur un métal - tel que le fer - conduit à une transformation chimique comme on l'a vu précédemment ;
La dissolution du sucre dans l'eau est un exemple de mélange, car le sucre et l'eau conservent leurs propriétés chimiques ;
La fusion de la glace est un exemple de transformation physique, car l'eau passe de l'état solide à l'état liquide sans changement de composition chimique.