I. Les états physiques et le cycle de l'eau (rappels)
Les états physique et le cycle de l'eau ont été introduits dans la fiche de cours suivante :
Pour rappel, l'eau existe sous trois états physiques : solide (glace), liquide (eau), gaz (vapeur d'eau).
Dans son cycle, l'eau peut-être observée naturellement sous différentes formes : neige, grêle (solide), ou encore pluie, givre, brouillard, buée (liquide).
Les changements d'états sont réversibles.
II. Les changements d'états de l'eau (rappels)
Les changements d'état de l'eau ont été introduits dans la fiche de cours suivante :
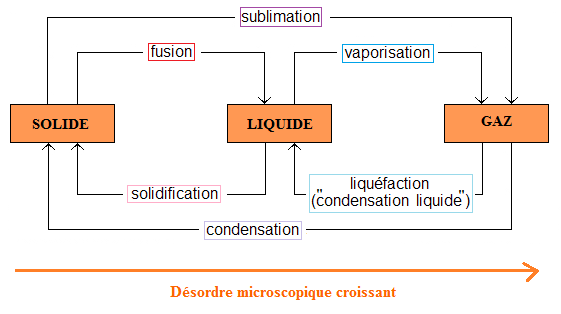
Chaque changement d'état (= passage d'un état physique à un autre) porte un nom qui lui est propre :
Le passage de l'état solide à l'état liquide est appelé la fusion ;
Le passage de l'état liquide à l'état solide est à contrario appelé la solidification ;
Le passage de l'état liquide à l'état gazeux est appelé l’évaporation
Le passage de l'état gazeux à l'état liquide est à contrario appelé la liquéfaction (souvent désignée abusivement par "condensation") ;
Le passage de l'état gazeux à l'état solide est appelé la condensation ;
Le passage de l'état solide à l'état gazeux est à contrario appelé la sublimation.
En synthèse :
III. Masse et volume
1. Masse (unité, conversion et mesure)
L'unité de masse dans le système international est le kilogramme (noté ).
Conversion d'unité :
Il est important de savoir convertir une unité en une autre. Cela a déjà été vu, par exemple dans la fiche suivante :
Conversion des unités de masse
Préfixes pour l'unité : kilo (), hecto (), déca (), déci (), centi (), milli (), micro (), nano (), pico ().
On voit donc facilement qu'un kilogramme, c'est mille fois un gramme donc ; un milligramme, c'est un millième de fois un gramme donc , etc.
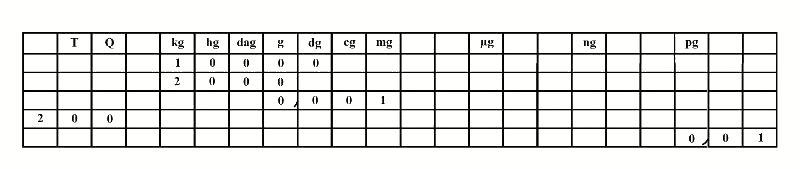
L'utilisation d'un tableau de conversion est extrêmement simple pour convertir dans une autre unité (à condition de l'avoir en tête) :
Si on veut convertir en , il suffit de placer le dans la colonne et de remplir de jusqu'à la colonne . On obtient donc .
Si on veut convertir en , on place le dernier chiffre () dans la colonne et on remplit de jusqu'à la colonne . On obtient donc .
Si on veut convertir en , on place le dans la colonne et on remplit de jusqu'à la colonne et sans oublier la virgule. On obtient donc .
Il n'est pas interdit de rajouter une colonne quand il en manque une (pour écrire tonnes ou picogramme par exemple).
Mesure de la masse d'un solide compact :
Pour mesurer la masse d'un solide compact, on utilise une balance et on lit sa masse sur le cadran.
Mesure de la masse d'un solide divisé :
Pour mesurer la masse d'un solide divisé, il y a deux façons :
Soit on pose un bécher sur la balance, on lit une masse puis on met le sable dans le bécher, on lit une masse et on fait la différence pour trouver la masse du sable ;
Soit on pose le bécher sur la balance numérique et on appuie sur le bouton "TARE" ce qui aura pour effet de mettre la masse à . On met ensuite le sable et on peut directement lire sa valeur sur le cadran.
Mesure de la masse d'un liquide :
La mesure de la masse d'un liquide se fait avec la même méthode que pour les solides divisés.
2. Volume (unité, conversion et mesure)
L'unité de volume dans le système international est le mètre cube (noté ). Cependant, l'unité usuellement employée dans la vie courante est le litre (noté ).
Il est important de savoir convertir une unité en une autre. Cela a déjà été vu, par exemple dans la fiche suivante :
Si l'utilisation du tableau des unités de masse est relativement simple, celui des volumes est un peu plus compliqué car il existe deux sortes de tableaux : celui des litres et des mètres cubes.
Le tableau des unités de volume en litre(s) correspond au tableau des unités de masse en remplaçant "gramme" par "litre" (kilogramme devient kilolitre, décagramme devient décalitre, milligramme devient millilitre) et en supprimant les colonnes tonne et quintal (la tonne et le quintal sont utilisés exclusivement pour les masses).
Le tableau des unités de volume en mètre(s) cube(s) a une particularité, celle de posséder trois sous-colonnes par colonne. C'est assez compréhensible car un mètre cube, c'est un mètre (une colonne) multiplié par un mètre (une colonne) multiplié par un mètre (une colonne). Il y a donc trois sous-colonnes par colonne.
La principale difficulté sera donc de convertir d'un tableau à l'autre. Le plus simple est d'apprendre quelques équivalences entre les deux tableaux. Les deux qu'on retient généralement sont :
et
De plus,
et
Exemples :
Pour convertir en , on utilise les équivalences. On convertit en litre soit puis on utilise l'équivalence ce qui donne .
Ensuite, on convertit en ce qui donne .
Mesure du volume d'un solide irrégulier : cas une pierre (par exemple)
On remplit une éprouvette graduée d'eau et on lit le volume en regardant la graduation de l'éprouvette.
On plonge la pierre dans l'éprouvette et on lit le volume. Le volume de la pierre est la différence entre le deuxième et le premier volume.
Attention : la lecture de la graduation se fait en lisant au bas du ménisque (forme arrondie de la surface libre).
Mesurer un volume d'un gaz :
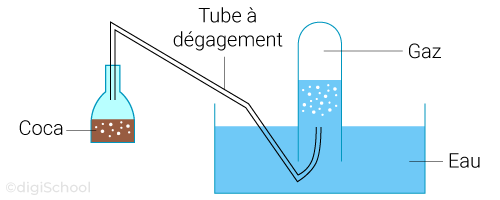
Un gaz peut être récupéré avec le protocole expérimental suivant :
On utilise un système de récupération de gaz par "déplacement" d'eau ;
Le gaz va s'échapper de la bouteille pour aller dans le tube à dégagement et va ensuite venir remplacer l'eau dans l'éprouvette graduée et on lit le volume.
3. Relation entre masse et volume
Il est possible d'établir en travaux pratiques une relation de proportionnalité entre la masse et le volume d’un corps homogène.
Cette notion, appelée masse volumique, sera vue plus en détail en classe de 4e.
IV. La température
1. Température d'un corps
La température sert à caractériser l'état d'un corps.
L'unité communément utilisée pour mesurer une température est le degré Celsius (noté ). Il existe plusieurs autres échelles de température : le degré Fahrenheit (, mesure anglo-saxonne) et le Kelvin (, unité du système international).
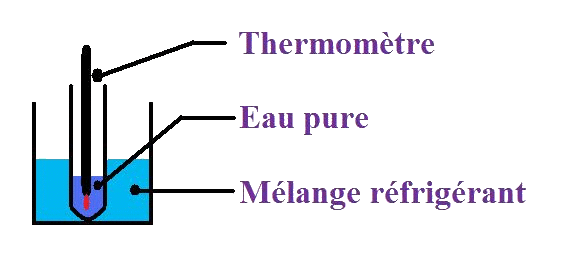
Pour mesurer la température, on utilise un thermomètre que l'on plonge là où on veut connaître la température.
2. Variation de la température lors d'un changement d'état
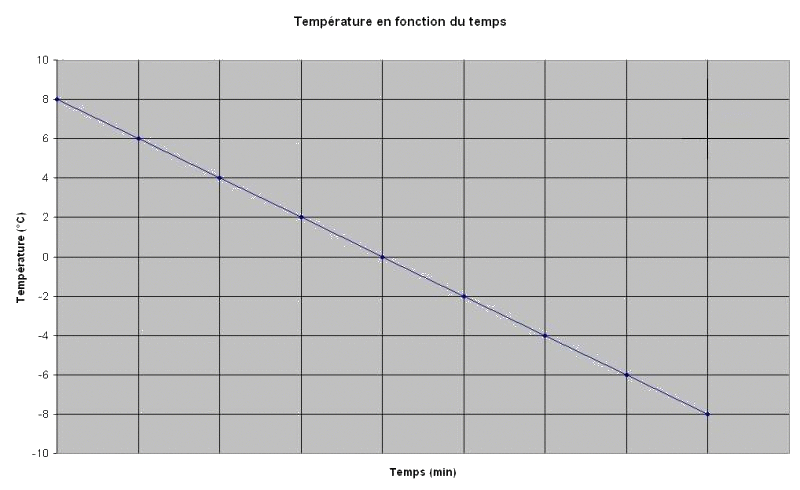
Expérience : soit un mélange réfrigérant (1/3 sel, 2/3 glace). Un tube à essai contenant 5 mL d'eau pure est plongé avec un thermomètre inséré pour suivre suivi de l'évolution de la température au cours du temps.
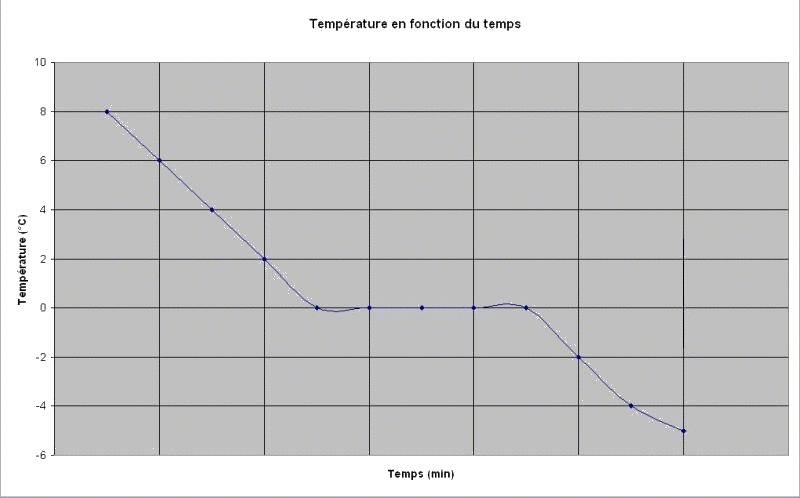
Résultat :
Voici le graphique obtenu de l'évolution de la température du tube à essai en fonction du temps.
On remarque que lors de la solidification à , la température reste constante. On dit qu'il y a existence d'un palier de température.
Palier de changement d'état :
Lors d'un changement d'état d'un corps pur, la température reste constante.
Ce palier de température est généralisable à tous les changements d'états pour un corps pur.
Remarque : en refaisant l'expérience avec de l'eau salée, on obtiendrait le graphique ci-dessous. On s'aperçoit qu'il n'y a pas de palier de température car c'est un mélange et l'eau salée ne se solidifie pas à mais à . C'est d'ailleurs pour cette raison que l'on verse du sel sur le verglas en hiver pour qu'il y ait fusion.