I. Introduction aux mélanges aqueux
1. Définitions
Solution : mélange liquide et homogène.
Solvant : liquide qui a la propriété de dissoudre ou de diluer des substances sans les modifier et sans se modifier lui-même.
Soluté : corps dissous par le solvant.
Solution saturée : solution qui ne peut plus dissoudre de soluté.
Solution insaturée : solution qui peut encore dissoudre du soluté.
Soluble : substance qui peut être dissoute.
Insoluble : substance qui ne peut pas être dissoute.
Miscible : deux liquides sont dits miscibles s'ils se mélangent totalement entre eux.
2. Un exemple de solvant : l'eau
L'eau, non toxique, est le solvant le plus courant car il permet de dissoudre un grand nombre de composés chimiques.
Les définitions données ci-dessus vont être illustrées grâce à des exemples de mélanges avec l'eau comme solvant.
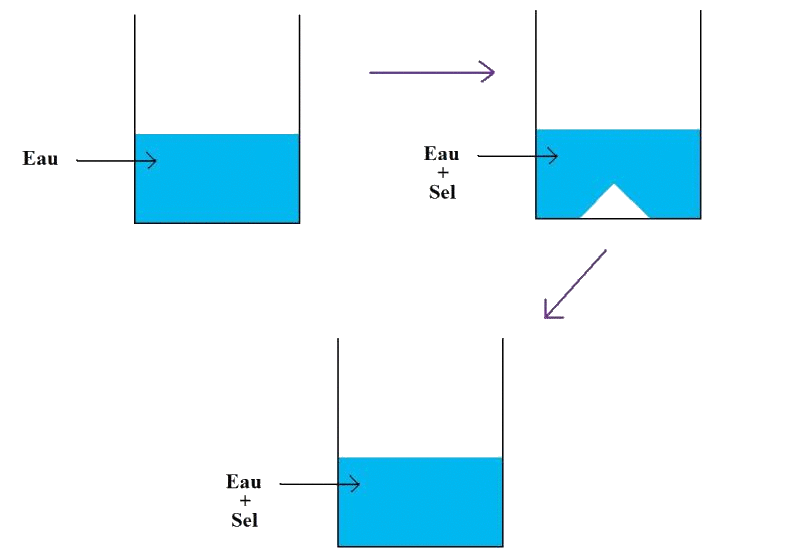
Expérience :
On remplit un petit bécher d'eau et on rajoute du sel. En mélangeant le contenu avec une cuillère, on remarque que le sel n'est plus visible.
Dans cette expérience, l'eau a dissous le sel. L'eau est le solvant et le sel est le soluté.
Observation :
Le mélange est homogène, c'est donc une solution.
On dit aussi que le sel est soluble dans l'eau.
Remarques :
Si on rajoute une trop grande quantité de sel dans le bécher, on remarque que l'eau n'arrive plus à dissoudre tout le sel introduit. On dit alors que la solution est saturée en sel.
Il peut arriver que l'eau ne puisse pas dissoudre certains composés comme de la limaille de fer ou le sable par exemple. On dit que dans ce cas qu'ils sont non solubles dans l'eau. On utilise alors d'autres types de solvants tels que l'éther anhydre, l'alcool, etc.
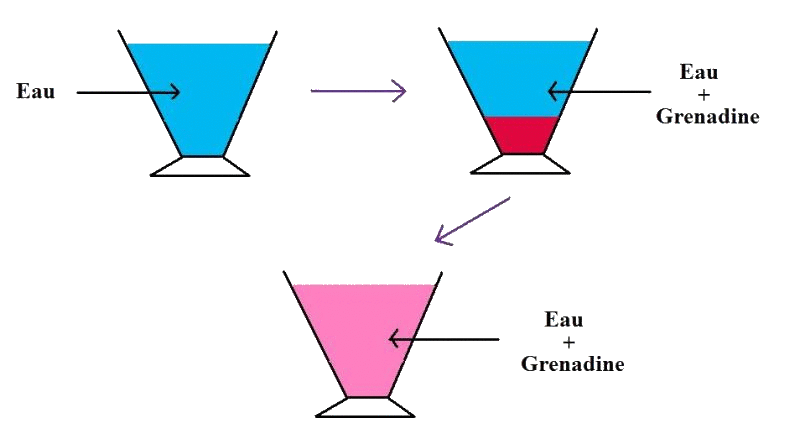
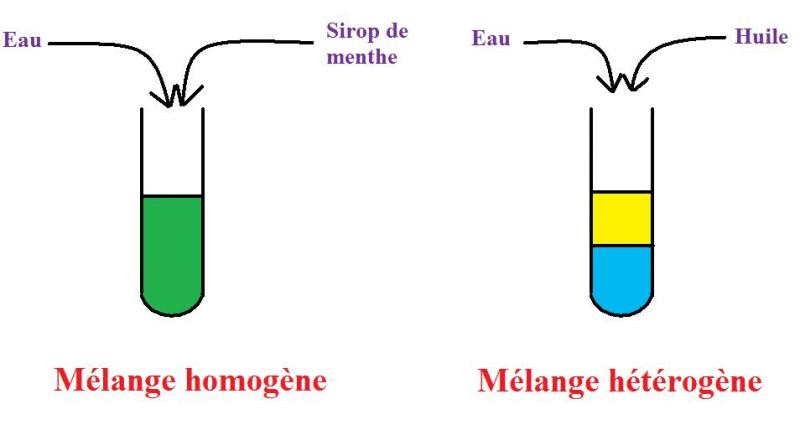
Expérience :
On introduit de l'eau dans un bécher puis du sirop de grenadine.
Observations :
On remarque qu'il y a deux phases bien distinctes, le mélange semble hétérogène et le sirop de grenadine ne paraît pas miscible avec l'eau.
Cependant, si on mélange l'eau et la grenadine (à l'aide d'une cuillère par exemple), le mélange va s'homogénéiser. Finalement, le mélange obtenu est alors homogène et la grenadine est donc miscible avec l'eau. On a donc bien une solution.
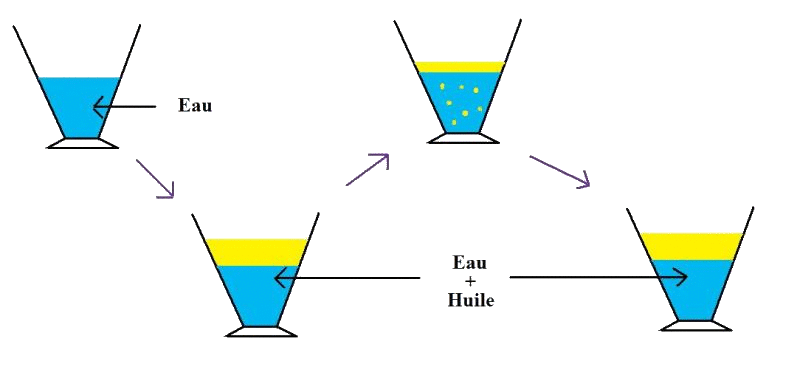
Expérience :
On introduit de l'eau dans un bécher puis de l'huile.
Observations :
Tout comme la grenadine, on remarque qu'il y a deux phases distinctes et le mélange semble hétérogène.
Faisons le même test qu'avec l'expérience précédente pour savoir si le mélange est réellement hétérogène : en mélangeant le contenu et en attendant un peu, on remarque que l'huile va remonter à la surface et redonner les deux phases distinctes du début. Le mélange obtenu est donc hétérogène et l'huile n'est pas miscible avec l'eau.
4. Test de la miscibilité pour les liquides
Pour savoir si deux liquides sont miscibles, ils sont introduits dans un bécher : le contenu est mélangé et est laissé au repos.
S'il ne reste qu'une seule phase alors le mélange est homogène et les deux liquides sont miscibles.
S'il reste deux phases alors le mélange est hétérogène et les deux liquides ne sont pas miscibles.
5. Conservation de la masse totale lors d'une dissolution
Comme vu précédemment, lors de la dissolution du sel dans de l'eau, le sel n'est plus visible après dissolution. Cependant, il n'a pas disparu comme il le laisserait croire. Pour montrer que la masse totale se conserve lors de la dissolution, il est possible d'effectuer une pesée avant et après dissolution.
Expérience :
On introduit d'eau dans un bécher et de sel. La pesée indique .
On mélange le contenu du bécher et l'eau dissout le sel.
Si on effectue une autre pesée, on verra que l'on a toujours une masse totale de , le sel est toujours présent même si on n'arrive pas à le voir.
Par une autre expérience, on peut mettre en évidence le fait que le sel n'a pas disparu.
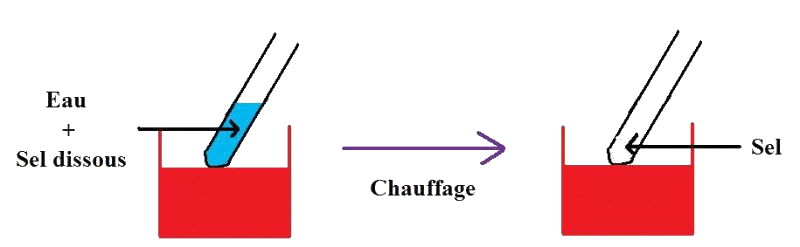
Expérience :
Dans un tube à essai, on dissout du sel dans de l'eau. Le sel est alors devenu invisible.
Pour montrer que le sel n'a pas disparu, on chauffe le tube à essai pour que l'eau s'évapore.
Quand toute l'eau s'est évaporée, on remarque qu'il reste un résidu solide : c'est le sel initialement introduit.
Conclusion : même si le sel est invisible quand il est dissous, il ne disparaît pas pour autant !
II. Corps pur et mélange
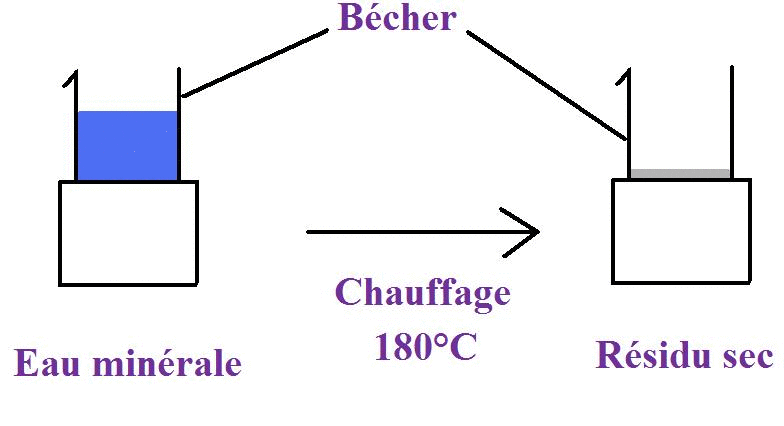
1. L'eau minérale est-elle un mélange homogène ?
L'eau pure a pour formule . Mais l'eau que nous buvons est-elle uniquement composée de molécules ?
Expérience par évaporation :
Grâce à une expérience très simple, il est possible de démontrer que des liquides d'apparence homogène peuvent contenir d'autres composés.
Pour ce faire, 1 litre de cette eau minérale (dont l'étiquette est ci-dessus) est versée dans un bécher et est chauffée à .
En éliminant totalement l'eau, on obtient en moyenne d'un résidu sec solide. Ceci illustre bien le fait que l'eau minérale n'est pas pure.
2. Définitions
Un corps pur est une substance constituée d'atomes ou de molécules de la même espèce chimique (par exemple l'eau pure ne contient que des molécules ). En d'autres termes, cette espèce chimique ne peut pas être décomposée, c'est-à-dire qu'elle ne comporte pas plusieurs espèce chimiques différentes (c'est-à-dire qu'un seul constituant).
Un mélange est une substance (liquide, solide ou gaz) constituée de plusieurs corps purs.
Remarques :
Un mélange est donc une introduction dans un même récipient de plusieurs substances qui n'ont pas forcément le même état ;
Un mélange aqueux est un mélange contenant de l'eau liquide.
III. Les mélanges homogènes et hétérogènes
1. Définitions
Mélange homogène : mélange contenant des substances que l'on ne peut pas distinguer les unes des autres ;
Mélange hétérogène : mélange contenant des substances que l'on peut distinguer les unes des autres.
Exemples :
Mélanges homogènes :
Eau + Cola frais ;
Vinaigre + Jus de citron ;
Cola + Jus de citron ;
Eau gazéifiée + Vinaigre d'alcool ;
Eau + Vinaigre de vin ;
Mélanges hétérogènes :
Huile + Vinaigre de vin ;
Huile + Cola ;
Huile + Vinaigre d'alcool ;
Eau gazéifiée + Huile ;
Eau + Huile.
II. Obtention d'une solution aqueuse limpide à partir d'un mélange hétérogène
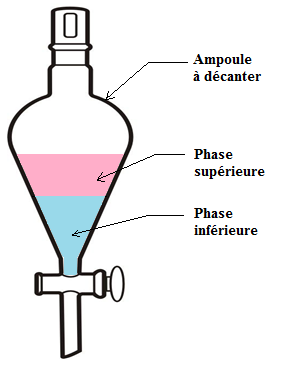
1. La décantation
Définition :
La décantation consiste à séparer les phases d'un mélange hétérogène liquide.
Elle se fait dans une ampoule à décanter.
Protocole expérimental :
On introduit le mélange hétérogène dans l'ampoule à décanter et on attend que les 2 phases se séparent : c'est la phase de décantation ;
Une fois que les deux phases sont nettement séparées, on ouvre le robinet afin de récupérer (ou d'éliminer) la phase située en dessous (ici, la phase aqueuse) : c'est la phase de séparation ;
Les phases sont séparées, l'opération est terminée.
Remarque :
La position de la phase organique ne sera pas la même suivant la masse volumique (voire la densité) du solvant extracteur par rapport à celle du solvant de départ :
Si sa masse volumique lui est inférieure, alors la phase organique sera au-dessus du solvant de départ ;
Si sa masse volumique lui est supérieur, alors la phase organique sera en-dessous du solvant de départ.Cette notion de masse volumique sera vue plus en détail en classe de 4e.
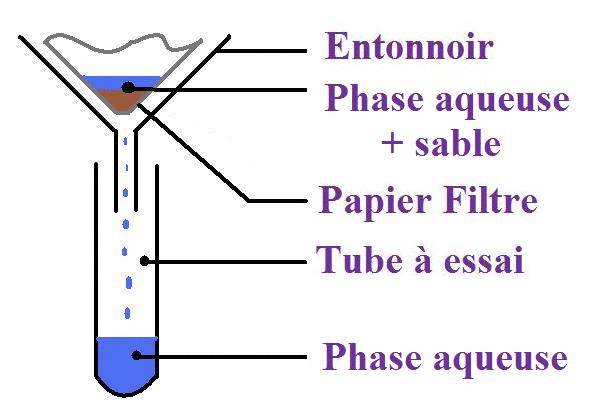
2. La filtration
Définition :
La filtration consiste à séparer la phase solide de la phase liquide d'un mélange.
Elle se fait à l'aide d'un entonnoir et d'un papier filtre.
Protocole expérimental :
On introduit le mélange (dans notre exemple, il s'agit d'eau et de sable) dans l'entonnoir muni du papier filtre ;
Le liquide va s'écouler à travers le papier filtre alors que le sable va être retenu ;
Il ne faut pas oublier d'agiter le sable car il pourrait bloquer la sortie de la phase aqueuse ;
L'opération est terminée quand la totalité de la phase aqueuse de l'entonnoir est dans le tube à essai.
III. Caractérisation d'une transformation (ou réaction) chimique
1. Expérience
Les photographies ci-dessous sont celles d'une réaction chimique entre l'acide chlorhydrique et le calcaire à l'état initial (avant le mélange, à gauche) et à l'état final (à droite) :
On a placé sur une balance un erlenmeyer rempli avec quelques millilitres d'acide dilué et on a posé à côté des morceaux de craie (calcaire). La balance indique une masse de grammes.
On met les morceaux de craie dans l'erlenmeyer et on observe une réaction chimique entre l'acide chlorhydrique et le calcaire (morceaux de craie), une effervescence se produit jusqu'à ce que tous les morceaux de craie soient dissous. Pendant toute la durée de l'expérience, la balance indique toujours la même masse de 23,8 grammes. Au cours d'une transformation chimique, la masse des réactifs qui disparaissent est égale à la masse des produits qui apparaissent, on dit que la masse se conserve. La conservation de la masse est une conséquence de la conservation des atomes au cours d'une transformation chimique : les atomes contenus dans les réactifs se retrouvent dans les produits.
Lorsque l'expérience est terminée, on retire le bouchon de l'erlenmeyer, on entend alors un gaz s'échapper et la balance indique une masse inférieure à 23,8 grammes. Le gaz qui s'échappe (dioxyde de carbone), il est donc pesant. En conclusion, la nature des corps a changé au cours de la réaction chimique mais il n'y a ni perte, ni création de matière.
2. Sécurité en chimie
Depuis , les étiquettes des produits ménagers doivent obligatoirement faire apparaître les dangers sous forme de pictogrammes de sécurité. Ces images informent les consommateurs sur les risques associés à ces produits, ainsi que les règles de sécurité à respecter.
Ces pictogrammes se retrouvent sur les produits utilisés lors des travaux pratiques de chimie. Il sera donc primordial :
De rechercher et exploiter des informations sur les contraintes de sécurité relatives à la manipulation des produits chimiques et sur les conséquences de ces produits sur les personnes et sur l’environnement ;
D'associer les pictogrammes de sécurité visibles dans le laboratoire de chimie aux dangers et aux risques qui leur correspondent.
VI. Pour aller plus loin : l'air, un mélange
L'air est un mélange transparent de plusieurs gaz mais ses deux principaux constituants sont :
Le dioxygène ;
Le diazote ;
L'air contient aussi d'autres gaz appelés « gaz nobles » (anciennement appelés « gaz rares ») : l'argon, le néon, l'hélium, le krypton et le xénon. Enfin, l'air contient une infime proportion de gaz à effet de serre : le dioxyde de carbone, le méthane et la vapeur d'eau.
Les proportions des différents gaz qui composent l'air sont :
Le dioxygène : environ ;
Le diazote : environ ;
Les gaz nobles environ ;
Le dioxyde de carbone, le méthane et la vapeur d'eau : environ .
Remarque : à des fins de simplification, il sera d'usage de dire que l'air est composé approximativement à de diazote et à de dioxygène.
= Merci à Skops pour avoir contribué à l'élaboration de cette fiche =