Introduction
Les analyses médicales reposent sur des principes chimiques simples mais appliqués avec une grande rigueur. Mesurer la concentration d’une substance dans le sang ou l’urine, préparer une solution à la bonne dose, identifier un ion par sa couleur : toutes ces opérations exigent de comprendre des notions comme la dissolution, la concentration, la dilution et le dosage. Ces concepts sont indispensables pour obtenir des diagnostics fiables et adapter les traitements aux besoins du patient.
Dissolution des solutés et équations de dissolution
Quand on ajoute un soluté dans un solvant, généralement de l’eau, il peut se dissoudre et former une solution.
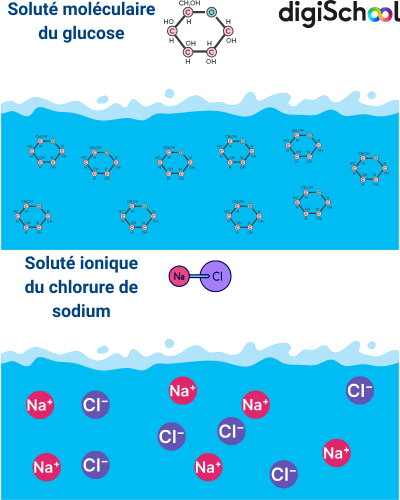
Un soluté moléculaire, comme le glucose (), se disperse en eau sous forme de molécules neutres sans libérer d’ions. L’équation de dissolution est alors : , où « » signifie en solution aqueuse (mélange homogène avec de l’eau).
Un soluté ionique, comme le chlorure de sodium (), se dissocie en ions lorsqu’il se dissout dans l’eau : .
Il faut toutefois préciser que certains composés, bien que moléculaires, peuvent partiellement se dissocier en ions en solution aqueuse. C’est le cas de nombreux acides (comme ), de certaines bases (comme ) ou encore d’alcools en conditions particulières. Cette nuance permet d’éviter une généralisation trop simpliste.
À retenir
Un soluté moléculaire reste sous forme de molécules dissoutes, un soluté ionique se dissocie en ions, et certains composés intermédiaires peuvent partiellement se dissocier.
Concentrations et utilisation en pratique médicale
La concentration traduit la quantité de soluté contenue dans un volume donné de solution. On distingue la concentration en masse et la concentration en quantité de matière.
La concentration en masse, notée , correspond au rapport de la masse de soluté dissoute (en grammes) au volume total de solution (en litres). La formule est et l’unité est le . Cette grandeur est utile pour exprimer directement la quantité de substance active administrée. Par exemple, une solution contenant 5 g de glucose dissous dans 100 mL d’eau a une concentration de , car équivalent à .
La concentration en quantité de matière, notée , correspond au rapport du nombre de moles de soluté au volume de solution (en litres). Elle s’exprime en . Par exemple, dissoudre de dans d’eau donne une concentration de .
Ces deux notions se complètent : l’une traduit une approche pratique (masse dissoute par litre), l’autre permet d’interpréter les réactions chimiques au niveau des particules. En pratique médicale, elles servent au calcul de doses. Ainsi, si un médicament doit être administré à raison de 0,5 g et que la solution disponible est à , le volume à injecter est , soit . Il faut insister auprès des élèves sur la conversion finale en , car c’est l’unité réellement utilisée en pratique clinique.
À retenir
La concentration en masse s’exprime en , la concentration en quantité de matière en . Le calcul d’une dose impose toujours de vérifier les conversions d’unités, notamment de litres vers millilitres.
Préparation de solutions : dissolution et dilution
La dissolution consiste à peser une masse de soluté, puis à la dissoudre dans un volume défini de solvant pour obtenir une solution de concentration donnée. La dilution, quant à elle, permet de préparer une solution moins concentrée à partir d’une solution mère. Elle repose sur la relation . Il faut rappeler que et représentent des volumes de solution, et non de solvant, car cette confusion est fréquente chez les élèves.
Par exemple, pour obtenir d’une solution à à partir d’une solution mère à , on prélève de solution mère (calculé avec la formule) et on complète avec de l’eau distillée jusqu’à atteindre .
À retenir
La dilution repose sur la relation , où les volumes sont ceux de solution.
Identification d’espèces colorées en solution
Certaines espèces chimiques se reconnaissent par leur couleur.
L’ion cuivre (II) () donne une solution bleue.
L’ion fer (III) () est incolore à légèrement jaune en solution aqueuse simple, mais il apparaît jaune-brun en cas d’hydrolyse ou lors de la formation de complexes, ce qui explique les différentes teintes observées selon les conditions.
Le permanganate () est violet intense. L’intensité de la couleur dépend directement de la concentration et du de la solution.
À retenir
La couleur renseigne sur la nature de l’ion, mais son intensité et sa nuance dépendent de la concentration et du milieu.
Dosage par étalonnage et spectrophotométrie
Dosage par étalonnage
Le dosage par étalonnage consiste à comparer la couleur d’une solution de concentration inconnue avec celles de solutions étalons de concentrations connues. On trace une droite d’étalonnage qui relie la concentration à l’intensité de la couleur.
Spectrophotométrie
La spectrophotométrie permet une mesure quantitative plus précise. Elle repose sur la loi de Beer-Lambert : , où est l’absorbance mesurée, la concentration de l’espèce colorée et une constante dépendant de la solution et de la longueur d’onde utilisée. Plus la concentration est élevée, plus l’absorbance augmente proportionnellement.
Exemple : dans le cas du glucose, il faut rappeler qu’il n’est pas naturellement coloré. On utilise une réaction chimique préalable, souvent enzymatique avec la glucose-oxydase, qui produit une espèce colorée proportionnelle à la concentration de glucose. L’absorbance mesurée permet alors de déterminer la concentration grâce à la loi de Beer-Lambert. Les résultats s’expriment classiquement en (valeurs normales à jeun : à ), mais aussi en ( à ), unité encore couramment utilisée dans le cadre médical.
À retenir
L’étalonnage et la spectrophotométrie reposent sur la loi de Beer-Lambert (). Dans le cas du glucose, une réaction enzymatique préalable rend le dosage possible.
Conclusion
Les analyses médicales reposent sur des bases chimiques claires : dissolution, concentration, dilution et dosage.
Ces méthodes permettent de préparer des solutions précises, d’identifier certaines espèces par leur couleur et de mesurer leurs concentrations. Simples dans leur principe mais exigeant une grande rigueur, elles sont essentielles pour garantir des diagnostics fiables et ajuster les traitements aux besoins des patients.