Introduction
Lorsque l’on parle de pollution, on pense immédiatement aux fumées d’usine ou aux marées noires. Pourtant, une partie plus insidieuse de la contamination se joue dans les eaux, les sols et l’atmosphère. Les substances chimiques s’y accumulent, parfois invisibles, et finissent par influencer la santé humaine et l’équilibre des écosystèmes.
C’est pourquoi l’analyse régulière de ces milieux est devenue un outil essentiel : elle permet de détecter les polluants, de suivre leur évolution et de prévenir leurs effets. Comment ces substances circulent-elles ? Pourquoi s’accumulent-elles ? Et surtout, quels risques posent-elles pour la biodiversité et pour l’être humain ? Autant de questions cruciales pour la santé publique et la protection de l’environnement.
Effets des polluants chimiques et réglementation
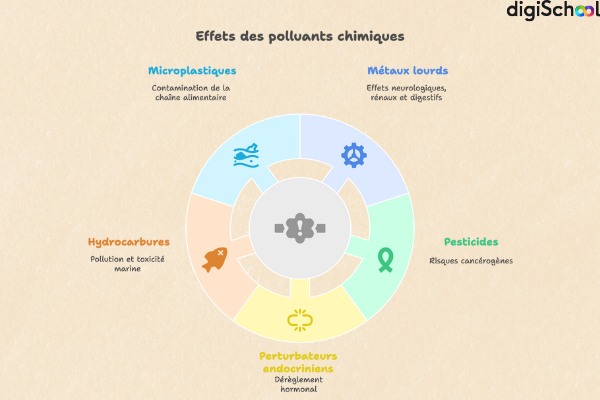
Les polluants chimiques se révèlent parfois nocifs même à des concentrations infimes. Certains sont des substances persistantes, c’est-à-dire des composés qui se dégradent très lentement dans l’environnement et restent actifs durant de longues années. Le plomb ou le mercure, classés parmi les métaux lourds, sont connus pour provoquer des atteintes neurologiques, rénales ou digestives. Les pesticides, largement utilisés en agriculture, suscitent une inquiétude particulière en raison de leurs effets cancérogènes.
Les perturbateurs endocriniens, quant à eux, sont des substances qui interfèrent avec le système hormonal (comme le bisphénol A ou les phtalates), perturbant la croissance, la fertilité ou le développement. Les hydrocarbures ont marqué l’actualité à travers les marées noires : ils empoisonnent la faune marine et posent un risque sanitaire aux populations côtières. Plus récemment, la recherche a mis en lumière la prolifération des microplastiques, ingérés par les poissons et capables de transporter d’autres polluants le long de la chaîne alimentaire.
L’exposition peut être aiguë, lorsque l’organisme reçoit une dose importante en un court laps de temps, ce qui entraîne une intoxication immédiate. Elle peut aussi être chronique, quand l’ingestion de faibles doses répétées provoque des effets différés, parfois discrets mais insidieux. C’est cette exposition à faibles doses, particulièrement mise en avant dans le programme officiel, qui constitue aujourd’hui un enjeu majeur de santé publique.
Pour protéger la population, la réglementation fixe des limites de consommation. La DJA (dose journalière admissible) concerne les substances ajoutées volontairement, comme certains additifs alimentaires (par exemple l’acide ascorbique, ou vitamine C).
La DJT (dose journalière tolérable) s’applique aux contaminants présents de manière involontaire, comme le plomb. Ainsi, la DJT du plomb est fixée à de masse corporelle/jour par l’Autorité européenne de sécurité des aliments. Pour le bisphénol A, perturbateur endocrinien longtemps utilisé dans les plastiques, la valeur de tolérance a été drastiquement abaissée à en 2023, ce qui illustre l’importance de l’évaluation des risques.
À retenir
Les polluants chimiques peuvent être dangereux même à faible concentration. Les autorités fixent des seuils de sécurité sanitaire (DJA et DJT) pour limiter les risques liés à une exposition chronique.
Traçabilité et bioaccumulation
Les polluants ne disparaissent pas une fois libérés dans l’environnement. Certains s’accumulent progressivement dans les tissus des êtres vivants : c’est la bioaccumulation. Le cas du mercure illustre bien ce phénomène : dans les océans, il se concentre dans les poissons prédateurs comme le thon ou l’espadon, au point de représenter un danger pour les consommateurs humains.
À cela s’ajoute la biomagnification : plus on monte dans la chaîne alimentaire, plus la concentration d’un polluant augmente. Ainsi, un petit poisson contaminé transmet le mercure qu’il contient à son prédateur, qui l’accumule à son tour, et ainsi de suite jusqu’à l’homme. Le risque devient alors maximal pour les espèces situées au sommet de la chaîne.
La traçabilité vise, quant à elle, à suivre le parcours d’un polluant depuis sa source jusqu’à sa présence dans l’environnement ou dans la chaîne alimentaire. On peut la comparer à celle d’un produit alimentaire suivi du producteur jusqu’au consommateur : on identifie ainsi l’origine du contaminant, son trajet et son impact final.
À retenir
La bioaccumulation explique comment un polluant s’accumule dans un organisme vivant, tandis que la biomagnification montre son amplification dans la chaîne alimentaire. La traçabilité environnementale permet d’en suivre le cheminement à travers l’air, l’eau et les organismes vivants.
Acidification des eaux et des océans
L’acidification des milieux aquatiques provient de la dissolution de certains gaz dans l’eau. Le dioxyde de carbone ( ), par exemple, forme de l’acide carbonique qui libère des ions hydrogène et abaisse le . De même, le dioxyde de soufre (), en se dissolvant, génère des acides capables de perturber les équilibres chimiques.
Dans le cas du , on retrouve une succession d’équilibres acido-basiques :
Autrement dit, c’est la libération d’ions au cours de ces transformations qui est responsable de la baisse du pH. Ces couples ( et ) permettent de comprendre précisément le phénomène d’acidification.
Ces réactions ont de graves conséquences écologiques. Les excès d’ions fragilisent les coquilles calcaires des mollusques et coraux, provoquent un stress physiologique pour les espèces sensibles et bouleversent la composition des communautés marines. L’acidification des océans est aujourd’hui considérée comme l’un des effets les plus préoccupants des émissions de gaz à effet de serre, au même titre que le réchauffement climatique.
À retenir
L’acidification des océans résulte de la libération d’ions par les couples acido-basiques du carbone. Elle modifie les équilibres chimiques et menace directement la biodiversité marine.
Protocole illustrant l’acidification par dissolution de CO₂
Une expérience simple permet de mettre en évidence ce phénomène. On remplit un bécher d’eau distillée et l’on mesure son . Théoriquement neutre (), l’eau peut en réalité présenter un plus bas, autour de à , car elle absorbe naturellement du atmosphérique. Ensuite, on fait buller du dioxyde de carbone dans l’eau, par exemple en faisant réagir un carbonate avec un acide.
On observe alors une baisse supplémentaire du , signe que l’eau est devenue plus acide. Cette acidité est liée à une série d’équilibres chimiques :
Ainsi, ce n’est pas un ion qui apparaît, mais bien la molécule d’acide carbonique, instable, qui se dissocie partiellement et libère des ions responsables de l’acidification. Ce protocole pédagogique illustre concrètement ce qui se produit à grande échelle dans les océans soumis à l’excès de atmosphérique.
À retenir
La dissolution du conduit à la formation d’acide carbonique, qui libère des ions . Cette libération explique la baisse du observée dans les océans
Conclusion
Analyser les milieux naturels, c’est dévoiler les menaces invisibles qui pèsent sur la santé humaine et sur les écosystèmes fragiles. Polluants toxiques, substances persistantes, microplastiques ou acidification des océans : chaque phénomène rappelle l’importance de la vigilance scientifique. En reliant traçabilité, bioaccumulation et biomagnification, la science contribue à prévenir les risques. Mais elle invite aussi à réfléchir à nos modes de production durable et de consommation, afin de répondre aux grands défis actuels : santé publique, protection de la biodiversité et lutte contre le changement climatique.