Introduction
Boire un verre d’eau claire peut sembler anodin, mais derrière ce geste quotidien se cache une vigilance scientifique rigoureuse. Toutes les eaux disponibles dans la nature ne sont pas directement consommables : elles doivent répondre à des critères stricts de qualité pour être déclarées potables.
Ces critères, établis au niveau européen par la directive (UE) 2020/2184 relative à la qualité des eaux destinées à la consommation humaine, et repris dans le code de la santé publique en France, visent à protéger la santé. Ils concernent notamment la composition ionique, le pH, la salinité, la température ou la présence éventuelle de polluants. L’étude de la solubilité des composés ioniques, de la conductivité des solutions et l’utilisation de techniques comme le dosage conductimétrique permettent d’évaluer si une eau est propre à la consommation.
En parallèle, l’impact croissant des activités humaines sur les ressources en eau rend ces analyses d’autant plus indispensables.
Solubilité et conductivité de l’eau
La solubilité d’un composé ionique correspond à la quantité maximale de ce composé pouvant se dissoudre dans une certaine quantité d’eau. Grâce à sa polarité, l’eau est un excellent solvant pour de nombreux sels minéraux comme le chlorure de sodium () ou le sulfate de calcium ().
La conductivité électrique d’une eau dépend de la quantité d’ions libres qu’elle contient. Une eau pure, théoriquement sans ions, a une conductivité quasi nulle. À l’inverse, une eau naturelle (rivière, source) contient divers ions dissous comme , , ou , ce qui augmente sa conductivité. Enfin, une solution très concentrée en ions, comme l’eau salée, présente une conductivité élevée car les charges électriques circulent facilement.
À retenir
L’eau conduit l’électricité grâce aux ions dissous. Plus elle en contient, plus sa conductivité est élevée.
Concentration ionique et types d’eau
La concentration ionique peut s’exprimer en masse (), c’est-à-dire la masse de soluté dissous par litre de solution, ou en quantité de matière (), qui correspond au nombre de moles de soluté par litre.
On distingue deux types d’eaux particulières : l’eau distillée, obtenue par distillation (une technique de séparation qui consiste à chauffer un liquide pour le vaporiser puis à condenser ses vapeurs, permettant d’isoler et de purifier un composé en fonction de sa température d’ébullition), très pauvre en ions et en impuretés volatiles, et l’eau déminéralisée, produite par échange d’ions ou osmose inverse, également très pauvre en sels minéraux. Leur consommation n’est pas toxique, mais si elle est exclusive et prolongée, elle peut conduire à un phénomène appelé hypominéralisation, c’est-à-dire un appauvrissement en sels minéraux nécessaires au corps (comme le calcium ou le magnésium).
Dans la pratique, ce risque est très limité car on ne boit que rarement de telles eaux de manière continue.
À retenir
La concentration en ions peut être exprimée en masse ou en quantité de matière. L’eau distillée et l’eau déminéralisée ne posent pas de danger ponctuel, mais une consommation prolongée pourrait appauvrir l’organisme en minéraux essentiels.
Dosage conductimétrique et critères de potabilité
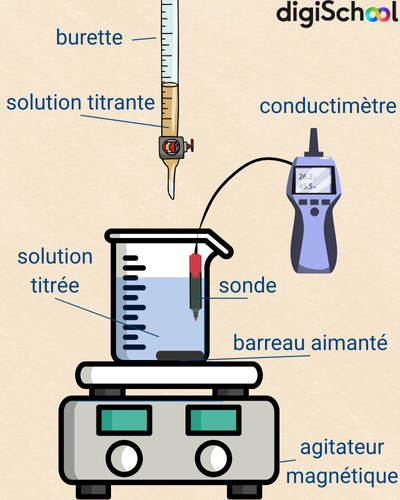
Dosage conductimétrique
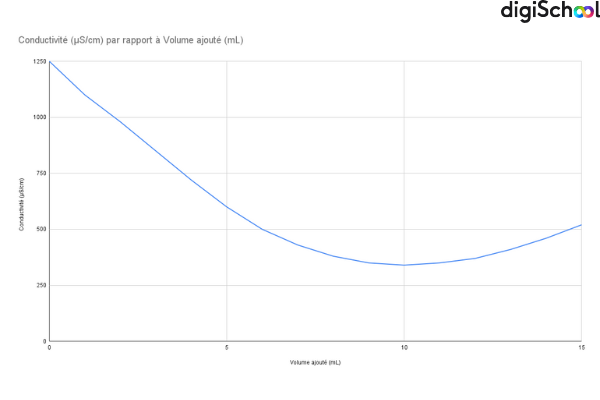
Le dosage conductimétrique consiste à suivre l’évolution de la conductivité d’une solution lorsque l’on ajoute progressivement un réactif. Au fur et à mesure que les ions réagissent pour former un précipité peu soluble, leur concentration diminue et la conductivité varie. La courbe obtenue montre une rupture nette : le point d’équivalence correspond au moment où tous les ions de l’espèce dosée ont réagi.
Cette méthode est particulièrement utile pour analyser des ions comme les sulfates (SO₄²⁻), les chlorures (Cl⁻) ou le calcium (Ca²⁺). En revanche, elle n’est pas adaptée aux nitrates (NO₃⁻), qui ne forment pas de précipité simple : leur dosage repose sur d’autres techniques, comme la spectrophotométrie UV.
Critères physico-chimiques de potabilité
La directive (UE) 2020/2184, transposée dans le code de la santé publique, définit des seuils précis à ne pas dépasser pour qu’une eau soit déclarée potable :
: entre 6,5 et 9. Une eau trop acide peut dissoudre des métaux des canalisations, tandis qu’une eau trop basique peut donner un goût désagréable.
Salinité : la concentration en chlorures () doit être , et celle en sulfates () , afin d’éviter un goût altéré et des troubles digestifs.
Nitrates () : , car un dépassement entraîne des risques d’intoxication, en particulier la méthémoglobinémie du nourrisson (« maladie du bébé bleu »).
Nitrites () : , car ils sont encore plus toxiques que les nitrates.
Métaux lourds : le plomb , le mercure , car ils provoquent des atteintes neurologiques et rénales.
Fluorures () : , car un excès fragilise les dents et les os.
Pesticides : par molécule, et pour le total, afin d’éviter des effets chroniques liés à l’accumulation.
Température : une valeur guide de en sortie de réseau est fixée. Une eau trop chaude favorise le développement microbien et dégrade son goût.
Ces seuils tiennent compte à la fois de la santé publique, de la perception sensorielle (goût, odeur) et de la stabilité de l’eau dans le réseau.
À retenir
Les critères de potabilité sont fixés par la directive européenne 2020/2184 et le code de la santé publique. Parmi eux : pH entre 6,5 et 9, nitrates , plomb , pesticides , température en sortie de réseau. Ces seuils garantissent une eau saine et agréable à consommer.
Effets des activités humaines sur la qualité des eaux
Les activités humaines modifient profondément la composition chimique des eaux. L’agriculture intensive est la première responsable de la pollution par les nitrates et les phosphates, issus des fertilisants. Ces derniers favorisent l’eutrophisation, un phénomène qui entraîne la prolifération d’algues et l’asphyxie des milieux aquatiques. Les détergents utilisés dans la vie domestique constituent également une source importante de phosphates.
Les industries rejettent des effluents acides ou basiques qui perturbent le .
Les centrales électriques peuvent réchauffer les cours d’eau et déséquilibrer les écosystèmes. La pollution organique issue des rejets domestiques diminue le dioxygène dissous, asphyxiant la faune aquatique.
Les conséquences sont aussi sanitaires. Les excès de nitrates peuvent provoquer des intoxications, les métaux lourds comme le plomb et le mercure s’accumulent dans l’organisme et endommagent le système nerveux, le foie et les reins. Les pollutions liées aux plastiques introduisent des perturbateurs endocriniens comme le bisphénol A ou les phtalates, qui perturbent l’équilibre hormonal et peuvent avoir des effets sur la reproduction ou le développement.
À retenir
Les activités humaines altèrent la qualité chimique de l’eau : nitrates et phosphates issus de l’agriculture, métaux lourds industriels, perturbateurs endocriniens comme le bisphénol A ou les phtalates. Les impacts touchent à la fois les écosystèmes (eutrophisation, perte de biodiversité) et la santé publique (intoxications, troubles neurologiques, perturbations hormonales).
Conclusion
La qualité d’une eau ne se résume pas à sa limpidité : elle dépend de critères physico-chimiques strictement réglementés par la directive européenne et le code de la santé publique. Comprendre la solubilité, la conductivité et les méthodes d’analyse comme le dosage conductimétrique permet d’évaluer si une eau est potable. Mais les pressions exercées par les activités humaines rappellent l’importance d’une surveillance régulière, d’une gestion durable et de choix de consommation responsables, afin de préserver à la fois la santé humaine et l’équilibre fragile des écosystèmes aquatiques.