Introduction
Lorsque tu ouvres un paquet de chips ou un pot de yaourt, tu fais confiance au fait que ces aliments n’ont pas perdu leurs qualités gustatives ni développé de substances dangereuses pour ta santé. Pourtant, entre leur fabrication et le moment où tu les consommes, ils ont souvent voyagé, parfois été stockés longtemps et exposés à des conditions variables. Pour éviter qu’ils ne se dégradent ou ne deviennent nocifs, des techniques scientifiques encadrent leur conservation et leur contrôle. Derrière un produit alimentaire, se joue donc un enjeu majeur de santé publique, mais aussi économique et social, dans un monde où les échanges alimentaires sont mondialisés et massifs. Comment les aliments se dégradent-ils et comment l’industrie parvient-elle à freiner ce processus tout en garantissant leur conformité aux normes sanitaires ?
Dégradation des aliments et facteurs influençant leur altération
Les aliments contiennent des molécules organiques – lipides, glucides et protéines – qui, avec le temps, subissent des transformations chimiques ou biologiques modifiant leur goût, leur odeur ou leur aspect.
L’oxydation est l’un des phénomènes les plus fréquents : le dioxygène de l’air réagit avec les lipides et provoque le rancissement des huiles, mais il peut aussi dégrader des vitamines ou des pigments naturels comme ceux des fruits rouges.
Autre réaction notable, l’hydrolyse des triglycérides : sous l’action de l’eau ou d’enzymes spécifiques appelées lipases, ces molécules se décomposent en glycérol et en acides gras libres. Cette réaction, fréquente lors du stockage des corps gras, altère la valeur nutritionnelle et donne parfois un goût désagréable aux aliments.
À ces phénomènes s’ajoute la réaction de Maillard, qui se produit entre les acides aminés (issus des protéines) et les sucres réducteurs. Elle est responsable du brunissement et de l’apparition d’arômes lors de la cuisson (croûte du pain, grillades, café torréfié). Si elle apporte des qualités gustatives recherchées, elle peut aussi, lorsqu’elle est trop poussée, générer des composés indésirables, dont certains potentiellement toxiques.
Ces réactions sont amplifiées par plusieurs facteurs. La présence de dioxygène favorise l’oxydation, tandis que la chaleur accélère toutes les réactions chimiques et stimule la prolifération microbienne. La lumière, en particulier les rayons ultraviolets, peut déclencher ou intensifier certaines oxydations. Enfin, les microorganismes – bactéries, levures ou moisissures – colonisent rapidement les denrées, comme on l’observe avec le pain moisi ou le lait caillé.
À retenir
Les aliments se dégradent sous l’effet de réactions chimiques (oxydation, hydrolyse, réaction de Maillard) et biologiques. Ces phénomènes sont accélérés par le dioxygène, la chaleur, la lumière et la prolifération microbienne.
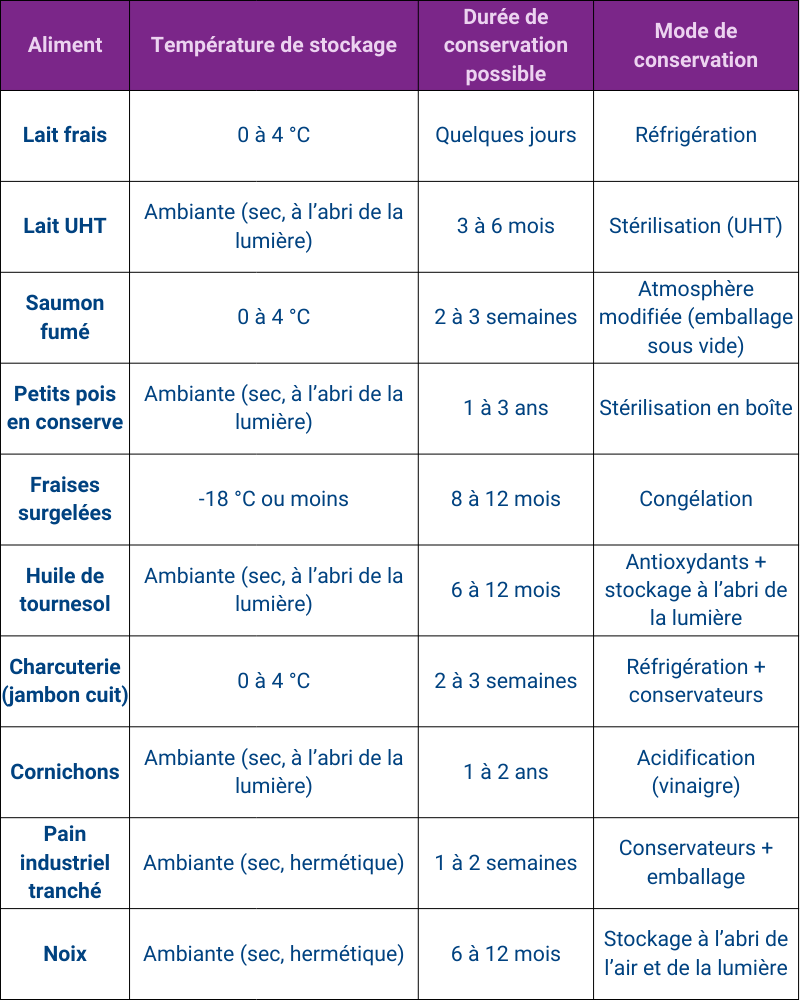
Procédés de conservation des aliments
Pour prolonger la durée de vie des aliments, l’agroalimentaire s’appuie sur des procédés qui neutralisent ou ralentissent ces mécanismes de dégradation.
Les méthodes physiques exploitent la température, l’eau ou l’atmosphère environnante. Ainsi, la réfrigération ou la congélation ralentissent la croissance microbienne et les réactions chimiques. Mais il faut préciser que la congélation n’élimine pas les microorganismes : elle se contente de suspendre leur activité. Lorsque l’aliment est décongelé, les bactéries ou moisissures peuvent à nouveau se développer si les conditions leur sont favorables. La pasteurisation et la stérilisation, en revanche, détruisent les microorganismes par la chaleur – c’est le principe du lait UHT ou des conserves.
Le séchage ou la lyophilisation retirent l’eau, privant ainsi les microbes d’un milieu favorable. Enfin, le conditionnement sous atmosphère modifiée (c’est-à-dire un emballage où l’air a été remplacé par un autre mélange gazeux) comme le vide ou l’enrichissement en azote, réduit la quantité de dioxygène et freine l’oxydation.
Les méthodes chimiques consistent à introduire des substances limitant les dégradations.
Les antioxydants comme la vitamine C ou E retardent l’oxydation, tandis que les conservateurs (nitrates dans certaines charcuteries, sorbate de potassium dans des produits de boulangerie) bloquent la croissance microbienne. Cependant, certains conservateurs doivent être utilisés avec prudence : les nitrates et nitrites peuvent, dans certaines conditions, se transformer en nitrosamines, des composés potentiellement cancérogènes. C’est pourquoi leur usage est strictement encadré par la réglementation.
Enfin, l’acidification – ajout d’un acide comme le vinaigre ou l’acide citrique – rend le milieu défavorable aux microorganismes. Elle agit en abaissant le pH, or ce paramètre est déterminant : plus un milieu est acide, moins il permet le développement bactérien. C’est le principe des cornichons dans le vinaigre ou de nombreux jus de fruits acides qui se conservent naturellement mieux.
À retenir
Les procédés physiques reposent sur le froid, la chaleur, l’absence d’eau ou la modification de l’atmosphère. Les procédés chimiques utilisent des additifs ou modifient le pH pour freiner la dégradation, tout en respectant une réglementation stricte pour limiter les risques liés à certains conservateurs.
Contrôle de la qualité chimique des aliments
Dosage chimique
Pour garantir la sécurité alimentaire, il ne suffit pas de conserver : il faut aussi contrôler.
Les laboratoires utilisent le dosage chimique afin de déterminer la quantité d’une substance présente dans un aliment.
Le titrage repose sur une réaction chimique précise : on ajoute un réactif jusqu’au point d’équivalence, ce qui permet de calculer la concentration. La spectrophotométrie (technique qui mesure l’intensité de la lumière absorbée par une solution) repose sur la loi de Beer-Lambert, qui établit une relation de proportionnalité entre l’absorbance et la concentration.
Plus une solution absorbe de lumière à une longueur d’onde donnée, plus sa concentration est élevée. Ces techniques servent, par exemple, à mesurer la teneur en acides gras libres pour évaluer la fraîcheur d’une huile, ou la quantité de vitamine C dans un jus afin de vérifier que l’étiquetage correspond à la réalité.
Normes toxicologiques
Ces analyses prennent tout leur sens lorsqu’elles sont comparées à des valeurs de référence définies par les autorités sanitaires.
La DJA (Dose Journalière Admissible) correspond à la quantité maximale d’un additif volontairement ajouté qu’une personne peut ingérer quotidiennement sans risque.
La DJT (Dose Journalière Tolérable) fixe la quantité maximale d’un contaminant non intentionnel (par exemple un résidu ou un polluant) qu’une personne peut ingérer sans danger.
Ces seuils sont déterminés à partir d’expérimentations toxicologiques qui identifient la NOAEL (No Observed Adverse Effect Level), c’est-à-dire la dose maximale sans effet néfaste observable. Pour garantir une marge de sécurité, cette valeur est divisée par un facteur de sécurité (souvent compris entre 100 et 1 000) afin d’obtenir la DJA ou la DJT. Ainsi, les valeurs retenues pour le consommateur sont largement inférieures aux doses potentiellement dangereuses.
Calcul associé
Si la DJA d’un additif est de 0,3 mg·kg⁻¹ et qu’une personne pèse 60 kg, la dose maximale qu’elle peut ingérer est :
par jour.
Ce type de calcul permet de vérifier que la consommation d’un aliment reste sans risque.
À retenir
Le contrôle de la qualité repose sur des dosages chimiques et la comparaison aux normes toxicologiques. La DJA (dose journalière admissible) s’applique aux additifs autorisés, la DJT (dose journalière tolérable) aux contaminants. Elles sont établies à partir de la NOAEL (dose sans effet observable) divisée par un facteur de sécurité, garantissant une large marge de protection pour la santé.
Conclusion
La sécurité physico-chimique des aliments s’appuie sur une compréhension fine des réactions de dégradation, l’utilisation de procédés de conservation adaptés et un suivi rigoureux de la composition chimique.
Grâce à cette triple vigilance, les produits restent consommables, sûrs et conformes aux attentes de la santé publique. Dans un contexte de mondialisation et de transition écologique, ces enjeux prennent une importance croissante : il s’agit non seulement de protéger le consommateur, mais aussi de réfléchir à des procédés plus durables, respectueux de l’environnement et économes en énergie.