Introduction
Respirer semble naturel, mais la qualité de l’air que nous inhalons conditionne directement notre santé et influence le climat. Sa composition en gaz, son équilibre chimique et la présence éventuelle de polluants déterminent s’il est bénéfique ou dangereux. Étudier l’air, c’est donc comprendre à la fois le mélange gazeux vital qui nous entoure et les risques sanitaires ou environnementaux liés à sa modification.
Composition de l’air et détection des gaz
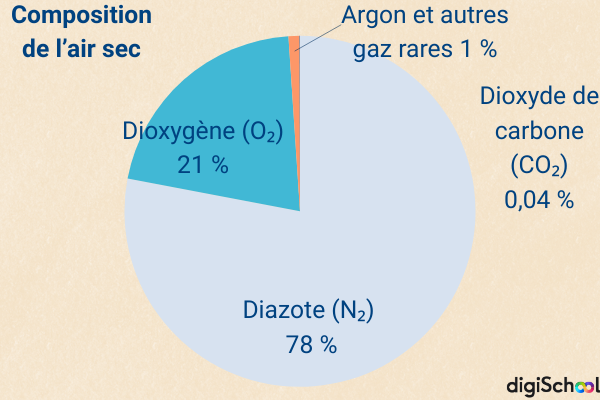
L’air sec est un mélange dominé par le diazote , qui représente environ 78 % en volume.
Le dioxygène , indispensable à la respiration, en constitue 21 %, tandis que l’argon et les gaz rares atteignent environ 1 %. Le dioxyde de carbone , quant à lui, ne représente qu’environ 0,04 %, soit environ 400 ppm (parties par million, c’est-à-dire 400 molécules de pour un million de molécules d’air).
Cette proportion n’est pas fixe : elle varie légèrement selon les lieux et les saisons et, surtout, elle tend à augmenter depuis deux siècles sous l’effet des activités humaines. C’est cette hausse progressive qui contribue directement au changement climatique.
Ces proportions peuvent être exprimées en fractions molaires ou en pourcentages molaires (fraction molaire × 100).
Pour identifier certains gaz, des expériences simples peuvent être réalisées. Le dioxyde de carbone trouble l’eau de chaux en donnant un précipité de carbonate de calcium.
La vapeur d’eau colore en bleu le sulfate de cuivre anhydre, poudre initialement blanche, et fait passer le papier cobalt du bleu au rose. Quant au dioxygène , il se détecte grâce au test de la bûchette incandescente, qui se rallume au contact du gaz.
La proportion d’oxygène peut être mesurée par réaction chimique ou à l’aide d’appareils de mesure modernes.
À retenir
L’air est essentiellement constitué de diazote et de dioxygène . Le dioxyde de carbone est présent à environ 0,04 % (soit 400 ppm) mais cette proportion tend à augmenter. Certains gaz se détectent par des tests chimiques simples comme l’eau de chaux pour le , le papier cobalt pour la vapeur d’eau ou la bûchette incandescente pour le .
Loi des gaz parfaits et stockage de dioxygène
La loi des gaz parfaits exprime le lien entre pression, volume, température et quantité de matière selon la relation :
.
C’est une modélisation simplifiée : elle décrit bien le comportement des gaz dans des conditions modérées, mais elle devient moins fiable à très haute pression, où les gaz réels s’écartent de ce modèle.
Malgré cette limite, elle reste suffisante pour modéliser l’oxygène comprimé dans les bouteilles médicales.
Prenons un exemple pas à pas : une bouteille de dioxygène médical a un volume intérieur de et une pression de . À pression atmosphérique (), le volume de gaz équivalent se calcule en multipliant le volume de la bouteille par le rapport de pressions : litres de dioxygène disponibles.
Si le débit de sortie est réglé à , on divise ce volume par le débit : minutes, soit environ 12 heures d’autonomie.
Dans la pratique médicale, cette loi permet de calculer la quantité de dioxygène disponible à partir de la pression et du volume de la bouteille et d’estimer la durée d’utilisation en fonction du débit de sortie.
À retenir
La loi des gaz parfaits est une approximation utile pour calculer la quantité d’oxygène disponible dans une bouteille et déterminer son autonomie. Elle rappelle toutefois que les gaz réels s’écartent de ce modèle à très haute pression.
Risques liés au monoxyde de carbone
Le monoxyde de carbone est un gaz incolore et inodore produit lors de combustions incomplètes.
Il se fixe sur l’hémoglobine avec une affinité environ 200 à 250 fois plus forte que celle du dioxygène, formant de la carboxyhémoglobine, c’est-à-dire une hémoglobine liée au et donc indisponible pour transporter l’oxygène. Ce blocage du transport gazeux provoque une hypoxie qui se traduit par des céphalées, des vertiges et des nausées, puis une perte de conscience et, dans les cas graves, la mort.
Le diagnostic médical repose sur le dosage sanguin de la carboxyhémoglobine. Le traitement consiste à administrer de l’oxygène pur, parfois sous haute pression dans un caisson hyperbare, afin de chasser le de l’hémoglobine et de restaurer la capacité de transport de l’oxygène.
Une intoxication au monoxyde de carbone se manifeste d’abord par des céphalées (maux de tête), souvent accompagnées de vertiges et de nausées, signes précoces d’un manque d’oxygène dans le cerveau. Si l’exposition se poursuit, l’hypoxie (diminution de l’apport en oxygène aux tissus) s’aggrave et entraîne une perte de conscience. Dans les cas les plus sévères ou prolongés, l’intoxication peut être mortelle.
À retenir
Le monoxyde de carbone est dangereux car il forme de la carboxyhémoglobine, quand il prend la place de l’ sur l’hémoglobine, ce qui empêche l’hémoglobine de transporter l’oxygène. Le diagnostic repose sur son dosage sanguin et le traitement par oxygénation, éventuellement en caisson hyperbare.
Rôle protecteur et nocif de l’ozone
L’ozone possède une double nature. Dans la stratosphère (couche de l’atmosphère située entre environ 10 et 50 km d’altitude), il forme un écran protecteur qui absorbe une grande partie des rayons ultraviolets du Soleil.
Mais dans la troposphère (couche de l’atmosphère la plus basse, de la surface du sol jusqu’à environ 10 km), il devient un polluant secondaire. Sa formation repose sur la photolyse du dioxyde d’azote () : sous l’action de la lumière solaire, une molécule de se décompose en monoxyde d’azote et en un atome d’oxygène radicalaire .
Cet atome, très réactif, s’associe ensuite à une molécule de dioxygène pour former de l’ozone .
La présence de composés organiques volatils (COV) entretient ce processus en régénérant le , ce qui favorise une production continue d’ozone, ce phénomène est particulièrement marqué en période estivale, lorsque l’ensoleillement est fort et que le trafic routier libère de grandes quantités de et de COVCOV, expliquant les pics de pollution urbaine.
L’ozone troposphérique irrite les voies respiratoires, réduit la capacité pulmonaire et aggrave les pathologies respiratoires préexistantes.
À retenir
L’ozone protège dans la stratosphère, mais dans la troposphère il se forme par photolyse du et réactions avec les COV. Son accumulation est favorisée par l’ensoleillement et le trafic routier, ce qui en fait un polluant dangereux en été.
Gaz à effet de serre et impacts climatiques
Les gaz à effet de serre (GES) absorbent le rayonnement infrarouge émis par la Terre et retiennent la chaleur dans l’atmosphère.
La vapeur d’eau joue un rôle naturel majeur, le dioxyde de carbone provient surtout de la combustion des énergies fossiles et de la déforestation. Le méthane est émis par l’élevage, les zones humides et certaines industries, tandis que le protoxyde d’azote résulte de l’utilisation d’engrais azotés et de procédés chimiques.
À ces gaz s’ajoutent les gaz fluorés (), utilisés en réfrigération, climatisation ou électronique, dont le pouvoir de réchauffement global est particulièrement élevé malgré leur faible concentration.
L’accumulation de ces gaz intensifie l’effet de serre et provoque des conséquences visibles : fonte des glaciers, hausse du niveau des mers, multiplication d’événements météorologiques extrêmes.
Parallèlement, d’autres polluants atmosphériques comme les oxydes d’azote, l’ozone troposphérique et les particules fines n’ont pas d’effet significatif sur l’effet de serre mais représentent un risque direct pour la santé.
Ces substances aggravent les maladies respiratoires, favorisent les troubles cardiovasculaires et réduisent l’espérance de vie dans les zones fortement polluées.
À retenir
Les gaz à effet de serre, en particulier ceux issus des activités humaines comme le , le méthane, le protoxyde d’azote et les gaz fluorés, renforcent le réchauffement climatique. Les polluants atmosphériques comme les particules fines, les NOx et l’ozone troposphérique n’agissent pas sur l’effet de serre mais ont des conséquences graves sur la santé publique.
Conclusion
La qualité de l’air ne dépend pas uniquement de sa composition globale, mais aussi de la présence de polluants dangereux. Le monoxyde de carbone () illustre un risque immédiat et potentiellement mortel, l’ozone troposphérique et les oxydes d’azote expliquent des épisodes de pollution estivale, tandis que les gaz à effet de serre bouleversent le climat. Comprendre la chimie de l’air, c’est donc protéger la santé publique et saisir l’importance des enjeux environnementaux de notre époque.