I. Caractérisation et identification d'une espèce chimique
1. Masse volumique et solubilité dans un solvant
Définition :
La masse volumique d'un corps de masse et de volume est :
Unités :
est en (généralement en chimie) ;
est en (généralement en chimie) ;
est en (généralement en chimie).
Remarques :
Lorsqu'on mélange deux liquides non miscibles, celui qui a la masse volumique la plus faible sera au-dessus de celui dont la masse volumique lui est supérieure (par exemple : l'huile surnage l'eau) ;
L'air est un mélange de plusieurs gaz ( de et de ) qui a pour masse volumique dans des conditions normales de pression et de température ().
Définition :
La solubilité d'une espèce chimique est la masse maximale qu'on est en mesure de dissoudre dans un volume de solvant donné.
Unités :
est en (généralement en chimie) ;
est en (généralement en chimie) ;
est en (généralement en chimie).
Remarque : au-delà de cette valeur, le mélange devient hétérogène : la solution est dite saturée et le surplus d'espèce chimique introduit n'est pas dissout.
2. Températures de changements d'état
La notion de température de changement d'état est abordée dans la fiche suivante :
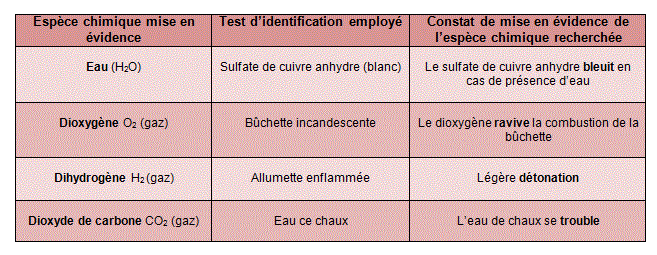
3. Tests de mise en évidence d'une espèce chimique
Les principaux tests de reconnaissance à connaître sont synthétisés dans le tableau suivant :
II. Chromatographie sur couche mince (CCM)
1. Principe de la chromatographie
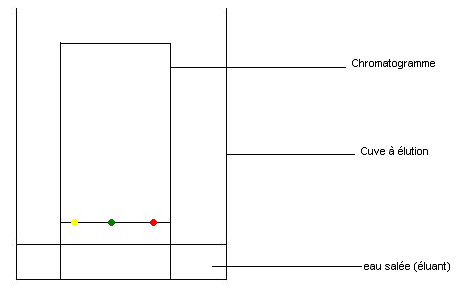
Procédé expérimental :
On prend du papier filtre ;
On trace un trait dans le sens de la largeur à du bord ;
Sur ce trait, on place colorants alimentaires de couleurs différentes : jaune, vert et rouge ;
Le papier filtre est appelé chromatogramme ;
On place le papier dans une cuve à élution qui contient d'eau salée (appelé éluant).
On attend une vingtaine de minutes (phase d'élution) ;
On obtient quelque chose ayant cette allure :
Observation :
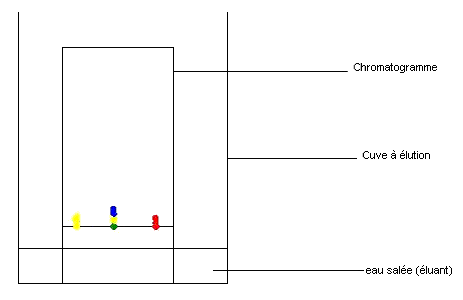
Les espèces contenues dans chaque colorant sont localisées à différentes hauteurs sur le papier filtre (chromatogramme) ;
Les colorants alimentaires sont plus ou moins entraînés par l'eau salée (éluant) ;
On constate que le colorant vert est un mélange de colorant jaune et de colorant bleu.
Conclusion :
La chromatographie permet la séparation des constituants d'un mélange ;
L'éluant monte par capillarité le long du papier filtre en entraînant avec lui les espèces chimiques - suivant leur solubilité - à différentes hauteurs.
Remarques :
Deux espèces migrant à la même hauteur (ou niveau) sont identiques.
Dans le cas d'espèces chimiques incolores, il est nécessaire de procéder à une révélation pour les rendre visibles (par exemple à l'aide d'une lampe UV).
2. Application : chromatographie de l'essence d'orange
Procédé expérimental :
Au lieu de prendre du papier filtre, on va prendre une plaque d'aluminium dont la surface est recouverte de silice : c'est le chromatogramme ;
On trace un trait dans le sens de la largeur à du bord ;
Sur ce trait, on place substances : limonène (jaune), citral (vert) et de l'essence d'orange (rouge) ;
On prendra comme éluant (mélange de solvant) du cyclohexane plus de l'acétone ;
On mettra un couvercle (pour que la vapeur de l'éluant remplisse la cuve) et on attendra ;
C'est ce qu'on appelle une chromatographie sur couche mince (CCM).
L'élution va se produire : l'éluant va entraîner pendant sa migration les substances constituant le mélange. Il les entraîne avec une vitesse d'autant plus grande que les substances sont solubles dans l'éluant.
Après une vingtaine de minutes, on peut dire que le chromatogramme est lisible.
Cependant, étant donné que les substances qui ont été entraînées sont incolores, on va plonger le chromatogramme dans une solution de permanganate de potassium.
Ensuite le chromatogramme sera violet mais les substances qui auront migré seront blanches, jaunâtres.
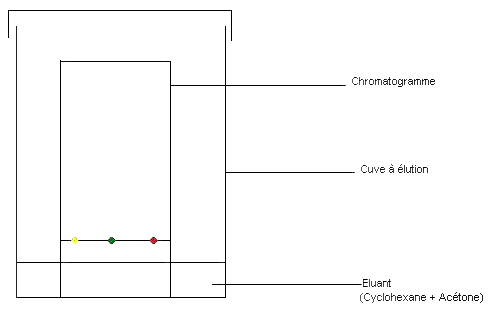
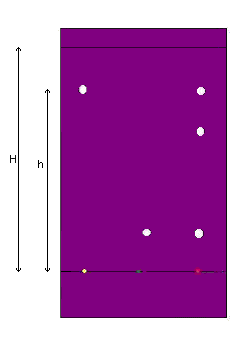
On va obtenir à peu près cela :
Observations et conclusions :
substances ( taches blanches au-dessus de l'essence d'orange) au moins constituent l'essence d'orange (au moins car il peut y en avoir d'autres mais elles ne sont pas apparues, n'étant pas solubles dans l'éluant utilisé).
Un des constituants du mélange est à la même hauteur que la tache du limonène.
Donc le limonène fait partie des substances qui constituent l'essence d'orange.
Pareil pour le citral, un constituant de l'essence d'orange est à la même hauteur que la tache de citral.
Donc le citral fait partie des substances qui constituent l'essence d'orange.
3. Calcul du rapport frontal
Reprenons le chromatogramme précédent :
Le trait qui est tout en haut s'appelle le front de l'éluant : c'est la hauteur à laquelle l'éluant est monté (on le laisse monter jusqu'à 0,5 cm du bord environ).
= hauteur de la tache de limonène en partant de la ligne de dépôt (où sont les 3 espèces chimiques).
= hauteur qui part de la ligne de dépôt jusqu'au front de l'éluant.
Le rapport frontal s'écrira donc :
Il permet d'identifier les constituants d'un mélange en comparant le rapport obtenu aux valeurs d'un tableau dans lequel plusieurs résultats de chromatogrammes ont été consignés, avec plusieurs éluants, et ce pour chaque espèce chimique.
= Merci à T_P pour avoir contribué à l'élaboration de cette fiche =