I. Les corps purs
1. Entité chimique - Espèce chimique
Définition :
Une entité chimique est une appellation générique se référant :
Soit à un atome ;
Soit à une molécule ;
Soit à un ion ;
Etc.
Définition :
Une espèce chimique est un ensemble d'entités chimiques (atomes, molécules ou ions) identiques.
2. Corps pur
Définition :
Un corps pur est une substance constituée d'atomes, de molécules ou d'ions de la même espèce chimique.
En d'autres termes, cette espèce chimique ne peut pas être décomposée, c'est-à-dire qu'elle ne comporte pas plusieurs espèces chimiques différentes.
Plusieurs types de corps purs peuvent être distingués selon la nature de l'espèce chimique qui les constitue :
Un corps pur élémentaire est un corps pur dont les atomes, tous identiques, ne sont pas liés en molécules.
Exemples : l'hélium , le néon ou l'argon sont des gaz rares. Ils ne se lient pas à d'autres éléments et restent ainsi isolés en atomes. , ou sont donc des corps purs élémentaires.
Un corps pur simple est une molécule composée de plusieurs atomes identiques.
Exemples : le dioxygène () ou l'ozone () sont exclusivement constitués d'atomes d'oxygène.
Le dihydrogène () est constitué de deux atomes d'hydrogène. Ce sont donc des corps purs simples.
Un corps pur composé est constitué de plusieurs types d'atomes liés entre eux.
Exemples : le sel ou chlorure de sodium () ou la caféine ().
II. Les mélanges
1. Notion de mélange
Définition :
Un mélange est une substance (liquide, solide ou gaz) constituée de plusieurs corps purs.
2. Mélange homogène
Définition :
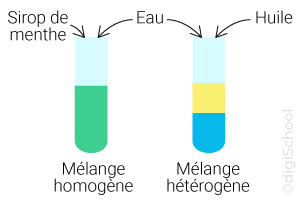
Un mélange est dit homogène s'il n'est pas possible de distinguer à l'œil nu ses différents constituants, même après une agitation.
Exemple : le mélange d'un sirop avec de l'eau.
Remarque : les mélanges homogènes peuvent se présenter dans l'un des trois états de la matière : solide, liquide ou gazeux.
3. Mélange hétérogène
Définition :
Un mélange est dit hétérogène s'il est possible de distinguer à l'œil nu ses différents constituants, même après une agitation.
Exemple : le mélange de l'eau avec l'huile.
Remarque : les mélanges hétérogènes peuvent se présenter dans un ou plusieurs états de la matière.
4. Composition massique des espèces d'un mélange
Propriété d'un mélange :
La masse totale d'un mélange correspond à la somme des masses de chaque corps pur introduit. Ainsi, un mélange est caractérisé par une conservation de la masse :
Cependant un mélange n'est pas caractérisé par une conservation du volume !
Définition :
Dans un mélange, de masse totale , si un corps pur a été introduit avec une masse , alors la composition massique de ce constituant dans le mélange est :
Remarque : une composition massique est sans unité et ont donc la même unité (généralement le gramme () en chimie).
IV. Identifications des espèces
1. La miscibilité
Définition :
Deux liquides sont dits miscibles s'ils forment, lorsqu'on les mélange, un mélange homogène.
S'ils forment un mélange hétérogène, alors les liquides sont dits non miscibles.
2. Les températures de changement d'état
Bien qu'en théorie, un corps puisse exister sous forme liquide, solide ou gazeuse, il est rare qu'on le trouve effectivement sous ces trois formes sur Terre : en effet, certains corps n'atteignent un ou plusieurs de leurs états qu'à des conditions extrêmes et rares.
Les températures de changement d'état dépendent de la pression.
La notion de température de changement d'état est abordée dans la fiche suivante :
3. La masse volumique
La notion de masse volumique est abordée dans la fiche suivante (§I.1.a.) :
Identification d'une espèce chimique
4. Exemples de tests chimiques communs
Les principaux tests de mise en évidence d'espèces chimiques communes sont également abordés dans la fiche suivante (§I.3.) :
Identification d'une espèce chimique
= Merci à shadowmiko pour avoir contribué à l'élaboration de cette fiche =