I. Les solutions aqueuses : définitions et propriétés
1. Notions de solvant et de soluté
Définitions :
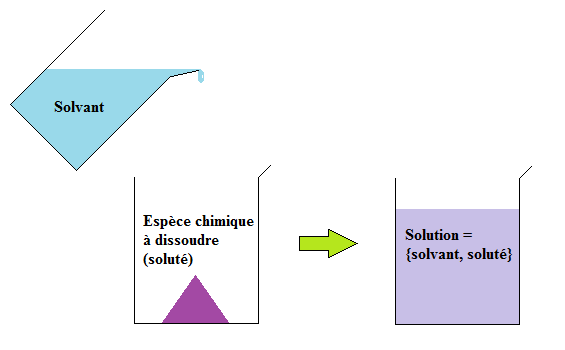
Une solution est un mélange liquide et homogène d'une ou plusieurs espèce(s) chimique(s).
Le solvant est l'espèce chimique majoritaire de cette solution : c'est un liquide capable de dissoudre une espèce chimique (qu'elle soit solide, liquide ou gazeuse), qu'on appelle le soluté.
La solution est le résultat de la dissolution d'un ou plusieurs soluté(s) dans le solvant. Les entités chimiques du soluté (molécules ou ions) se dispersent parmi les molécules du solvant.
Une solution est dite aqueuse lorsque le solvant utilisé pour dissoudre chaque espèce chimique est l'eau.
Schéma récapitulatif :
2. Solutions aqueuses moléculaires et ioniques
Définitions :
Une solution est dite moléculaire lorsque le soluté dissous est une molécule.
Une solution est dite ionique lorsque le soluté est dissous sous la forme d'ions.
Exemples :
Un morceau de sucre (molécule de glucose ) dissous dans l'eau est une solution moléculaire : ;
Du sel de cuisine en poudre (composé ionique ) dissous dans l'eau est une solution ionique : .
Propriétés :
Toute solution respecte le principe de conservation de la matière (en masse et en charge, voir la fiche de cours suivante pour plus de détails : Les transformations chimiques)
Une solution est dite saturée lorsque le soluté introduit n'est pas totalement dissous la solubilité du soluté (= masse maximale qu'on peut dissoudre dans un volume de soluté) a donc été dépassée.
Exemples :
L'eau sucrée préparée possède autant de molécules de glucose que le morceau de sucre dissous ;
L'eau salée préparée possède autant d'ions sodium et d'ions chlorure que la quantité de sel de table dissoute ; par ailleurs, le principe de conservation de la charge globale (autant de cations que d'anions ) est également respecté.
3. Notion de concentration en masse (ou concentration massique)
Définition :
Si le volume d'une solution contient la masse de l'espèce , alors la concentration en masse (ou massique) de dans cette solution est :
Unités :
Usuelles : est en ; est en ; ou est en ;
S.I : est en ; est en ; ou est en .
Définition :
Si on dissout une masse de soluté dans l'eau pour faire un volume de solution, alors la concentration en masse (ou massique) de cette solution est :
Unités :
Usuelles : est en ; est en ; ou est en ;
S.I : est en ; est en ; ou est en .
: ne pas confondre la notion de concentration massique avec celle de masse volumique !
II. Préparation d'une solution aqueuse par dissolution
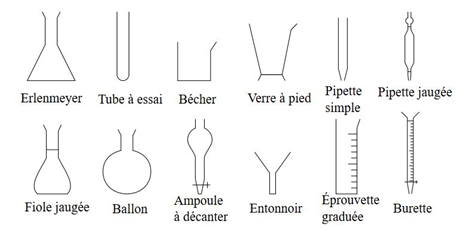
1. Rappels sur la verrerie utilisée en chimie
La verrerie principalement utilisée en chimie est la suivante :
Ce faisant, pour préparer une solution de concentration fixée avec précision, il est important d'utiliser une verrerie de précision :
Une pipette jaugée (à ou trait(s) de jauge) pour prélever un volume avec précision ;
Une pipette graduée ou burette graduée pour verser un volume avec précision ;
Une fiole jaugée pour préparer une solution avec précision.
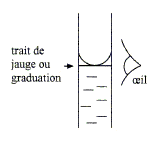
Dans tous les cas, quelle que soit la préparation de solution souhaitée, il est crucial de lire avec attention le trait de graduation ou le trait de jauge pour cela, la lecture du volume doit se faire au bas du ménisque tout en maintenant l'œil face à la graduation (pour éviter toute erreur de parallaxe) :
2. Solution aqueuse obtenue par dissolution
Exercice proposé :
On souhaite préparer une solution de concentration massique et de volume à partir de cristaux de permanganate de potassium : .
L'équation de dissolution du permanganate de potassium (= soluté) dans l'eau (= solvant) est :
Par définition de la concentration massique pour cette solution : si est la masse de cristaux de permanganate de potassium à dissoudre.
Finalement, la masse de cristaux à dissoudre vaut :
Protocole expérimental :
: dans une coupelle ou un bécher, à l'aide d'une spatule sèche, on pèse de cristaux de permanganate de potassium à l'aide d'une balance initialement tarée (pour ne pas inclure dans la pesée la masse de la coupelle ou du bécher) ;
: on rince la fiole jaugée de à l'eau distillée (pour éliminer les éventuelles impuretés présentes) ;
: on introduit les cristaux pesés dans la fiole jaugée, en utilisant la coupelle comme un entonnoir. On finit par rincer la coupelle à l'eau distillée, de manière à récupérer l'eau de rinçage dans la fiole jaugée (afin de ne pas perdre des cristaux pesés) ;
: on remplit environ à moitié d'eau distillée la fiole jaugée. On bouche l'orifice de la fiole à l'aide d'un petit bouchon en caoutchouc et on retourne la fiole plusieurs fois jusqu'à ce qu'il y ait dissolution complète des cristaux ;
: on rajoute de l'eau distillée dans la fiole jaugée à l'aide de la pissette d'eau distillée jusqu'au trait de jauge. On rebouche de nouveau la fiole et on la retourne plusieurs fois pour homogénéiser la solution.
La solution de permanganate de potassium voulue est prête !
III. Préparation d'une solution aqueuse par dilution
Remarque importante :
Le protocole de dilution ne s'invente pas !
Il s'agit d'un raisonnement clair et simple à condition de suivre suivre scrupuleusement - pour chaque TP ou exercice proposé - la méthode présentée ci-dessous.
Exercice proposé :
A partir de la solution de permanganate de potassium préparée précédemment, de concentration massique , on désire réaliser d'une solution de permanganate de potassium de concentration massique .
1. Compréhension du problème et calcul préalable
On souhaite préparer une solution de concentration par dilution de la solution de concentration .
Pour cela, il faut connaître le volume de solution à prélever pour pouvoir faire cette dilution.
On peut définir le facteur de dilution par :
2. Méthode de calcul du volume à prélever
Tout d'abord, il faut reporter sur la copie les données importantes de l'énoncé de la façon suivante :
Solution mère : solution de permanganate de potassium :
de concentration massique
de volume
Solution fille : solution diluée de permanganate de potassium
de concentration massique
de volume
On souhaite calculer . Pour cela, il est nécessaire de faire apparaître sur la copie la justification suivante (propriété) :
L'ajout d'eau ne modifie pas la quantité de matière du soluté présent dans la solution
Donc, on peut écrire l'égalité suivante :
Ainsi, le volume à prélever vaut .
Application numérique : .
On connaît désormais le volume de solution de permanganate de potassium à prélever.
Il reste donc à connaître la verrerie ainsi que le protocole utilisés pour réaliser cette dilution.
3. Verrerie utilisée pour préparer
La pipette jaugée (à l'aide d'une poire aspirante), dont la contenance est fixe, permet de prélever très précisément un volume préalablement calculé. Il en existe pour différents volumes. Ici, il faudra utiliser une pipette jaugée de (volume de la solution à prélever).
Remarques :
Les pipettes jaugées ne disposent que d'une ou deux graduation(s) qu'on appelle les « traits de jauge ». On considère que le volume mesuré correspond exactement à ce qui est contenu entre les deux traits de jauge.
Lorsque le second « trait de jauge » n'existe pas, il suffit de remplir la pipette jusqu'à son trait de jauge puis de la laisser se vider pour considérer que le volume correspondant a été mesuré.
Il existe également les pipettes graduées qui, comme leur nom l'indique disposent de graduations permettant de mesurer le volume prélevé.
La fiole jaugée permet de diluer le volume de solution prélevé. Ici, il faudra utiliser une fiole jaugée de (volume de la solution fille ) dans laquelle on introduira le volume prélevé. On remplira ensuite cette fiole d'eau distillée jusqu'au trait de jauge en suivant le mode opératoire qui suit.
4. Protocole de dilution
Rappel : on veut préparer, par exemple, 50,0 mL de solution de permanganate de potassium de concentration massique . Le volume à prélever est (calculé précédemment).
:
Verser la solution mère (à diluer) dans un bécher
Prélever de solution à l'aide d'une pipette jaugée à un ou deux trait(s) de jauge, munie d'une propipette (ou poire aspirante) ou d'un pipeteur
Ajuster le ménisque au trait de jauge.
:
Introduire la solution prélevée dans une fiole jaugée de
Si la pipette possède un deuxième trait (en bas), faire descendre le liquide JUSQU'À CE TRAIT (et pas plus sinon le volume de est dépassé !).
Remarque importante : pour être bien sûr que la dernière goutte tombe systématiquement de la pipette, la pipette doit être maintenue verticale et le bécher ou la fiole incliné. Cela est vrai aussi bien pour ajuster le liquide au trait de jauge supérieur, pour l'ajuster au trait de jauge inférieur (lorsqu'il existe) et pour être sûr que tout le liquide tombe de la pipette en absence de trait de jauge inférieur.
:
Remplir la fiole jaugée aux trois quarts avec de l'eau distillée.
Après l'avoir bouchée, l'agiter pour homogénéiser la solution.
:
Ajouter de l'eau distillée jusqu'au trait de jauge.
Ajuster le ménisque jusqu'au trait de jauge en faisant très attention.
:
Reboucher la fiole jaugée et la retourner plusieurs fois pour bien homogénéiser la solution.
C'est prêt ! Plus simple qu'une recette de cuisine !
Voici donc d'une solution fille de concentration réalisée par dilution à partir d'une solution mère de concentration massique .
IV. Dosage par étalonnage
1. Principe du dosage
Le dosage par étalonnage consiste à utiliser des solutions (dites étalons) qui contiennent l'espèce chimique à doser à différentes concentrations connues.
Ces solutions étalons sont préparées par dilutions successives, à partir d'une solution mère de concentration connue et suivant le même protocole expérimental que celui exposé ci-dessus.
La concentration en masse de l'espèce chimique à doser influe sur une grandeur mesurable, comme par exemple : la masse volumique, l'absorbance, etc.
On compare ensuite la grandeur physique mesurée pour l'échantillon à celles des solutions étalons afin de déterminer la concentration de l'échantillon.
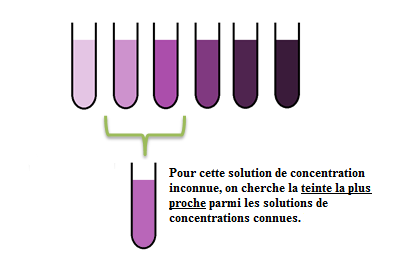
2. Utilisation d'une échelle de teinte
Une échelle de teintes est réalisée avec des solutions contenant une espèce colorée à des concentrations connues.
On compare, dans les mêmes conditions d'observation, la teinte de la solution inconnue avec celles de l'échelle de teinte, de manière à en déduire une valeur approchée ou encadrée de la concentration massique de la solution inconnue.
Exemple :
3. Exploitation d'une courbe d'étalonnage
On mesure une grandeur physique (masse volumique, absorbance, etc.) pour chaque solution étalon préparée (de concentration en masse ) et on trace la courbe , qu'on appelle la courbe d'étalonnage.
On mesure la grandeur d'une solution inconnue.
On en déduit par lecture graphique la concentration de cette solution.
Propriété :
Si la courbe d'étalonnage étudiée est une droite passant par l'origine alors les deux grandeurs et sont proportionnelles :
si est le coefficient de proportionnalité
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =