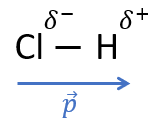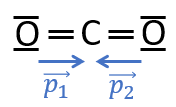I. Notion d'électronégativité
L'électronégativité est une grandeur relative (sans unité) mesurant l'aptitude d'un atome à attirer vers lui les électrons d'une liaison qui le lie à un atome voisin.
Il existe plusieurs échelles permettant d'affecter une valeur d'électronégativité aux atomes (échelle de Mulliken, échelle de Pauling).
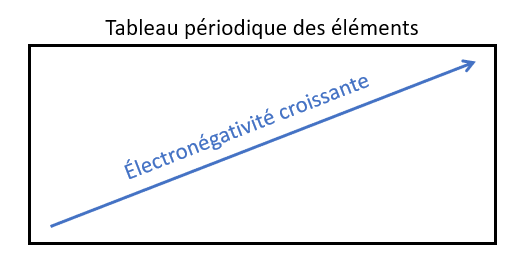
Évolution générale de l'électronégativité dans la classification périodique des éléments :
Sur une période donnée, l'électronégativité augmente lorsqu'on se déplace de gauche à droite ;
Dans une colonne donnée, l'électronégativité augmente lorsqu'on se déplace de bas en haut ;
Ainsi, l'élément le plus électronégatif est le fluor (la colonne des gaz rares est exclue de cette considération, les gaz rares étant peu électronégatifs).
II. Liaison polarisée
Liaison polarisée :
Une liaison covalente est polarisée dès que les deux atomes liés ont des électronégativités différentes, ce qui est le cas généralement quand les deux atomes impliqués dans la liaison sont différents.
Exemple de liaison polarisée "classique" :
Prenons comme exemple la molécule de chlorure d'hydrogène . Le chlore étant plus électronégatif que l'hydrogène, les électrons de la liaison covalente entre et sont plus attirés par que par . Si on zoomait sur le doublet d'électrons liant et , on constaterait localement un excès de charges négatives sur () et un défaut de charges négatives (ou encore un excès de charges positives) sur (). La liaison est alors équivalente à un doublet de charges séparées d'une distance , soit un dipôle électrique. La liaison est dite polarisée.
Les charges et , où , sont appelées charges partielles, car on peut écrire , où et est la charge électrique élémentaire valant . On note parfois et les charges partielles.
Moment dipolaire :
On note le moment dipolaire d'une liaison covalente polarisée. C'est un vecteur colinéaire à la liaison et orienté du pôle négatif vers le pôle positif de la liaison (qui est équivalente à un dipôle électrique).
La norme de ce vecteur est proportionnelle à la distance entre les deux pôles et à la valeur absolue de la charge d'un des pôles : .
La norme du moment dipolaire s'exprime en Debye (D), où . Les valeurs typiques de moments dipolaires pour les molécules diatomiques sont entre 0 et 11 D.
Une liaison covalente est d'autant plus polarisée que son moment dipolaire a une norme élevée. Une liaison n'est pas polarisée si et seulement si son moment dipolaire est nul.
Moment dipolaire de la liaison entre H et Cl dans la molécule de chlorure d'hydrogène :
Exemple de liaison non polarisée :
La liaison entre les atomes d'azote dans la molécule est quant à elle non polarisée car les atomes liés sont les mêmes et ils ont donc les mêmes électronégativités.
Exemple de liaison "très" polarisée : la liaison ionique
Lorsque la différence d'électronégativité entre les deux atomes impliqués dans la liaison dépasse un certain seuil, la liaison est tellement polarisée que l'atome le plus électronégatif s'approprie les électrons du doublet liant et devient un anion tandis que l'autre atome (le moins électronégatif) devient un cation. On ne parle alors plus de liaison covalente mais de liaison ionique.
Prenons la molécule de chlorure de sodium comme exemple : le chlore est tellement plus électronégatif que le sodium qu'il s'approprie la couverture électronique ; il garde son électron et récupère celui du sodium. va avoir un excès de charges négatives et Na un défaut de charges négatives. va devenir l'ion et l'ion . Ce ne sont plus ici des charges partielles mais des charges élémentaires .
III. Polarité d'une molécule
Une molécule est un groupement d'atomes liés entre eux par une ou plusieurs liaisons covalentes. En fonction de l'électronégativité des atomes constituant cette molécule, les liaisons covalentes peuvent être polarisées, conduisant à l'apparition de charges partielles et donc de moments dipolaires. Suivant la répartition de ces charges partielles dans l'espace, la molécule aura un caractère polaire ou apolaire :
Polarité d'une molécule :
Si la somme vectorielle des moments dipolaires des liaisons covalentes de la molécule est nulle (), la molécule est apolaire.
Si cette somme vectorielle est non nulle (), il existe alors dans la molécule deux pôles distincts, de charges électriques opposées. La molécule se comporte alors comme un dipôle électrique, elle est polaire.
Exemple d'une molécule apolaire :
Considérons la molécule de dioxyde de carbone . L'oxygène étant plus électronégatif que le carbone, chaque liaison entre et est polarisée, avec une charge partielle négative sur et une charge partielle positive sur (il y a donc deux charges partielles positives sur ). On note et les moments dipolaires des liaisons :
Les liaisons étant identiques, les moments dipolaires ont la même norme : .
La molécule de étant linéaire, et ont la même direction mais sont de sens contraires.
On a donc : . La somme vectorielle des moments dipolaires des liaisons covalentes de la molécule de est donc nulle, , cette molécule est donc apolaire.
Exemple d'une molécule polaire :
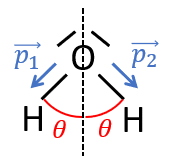
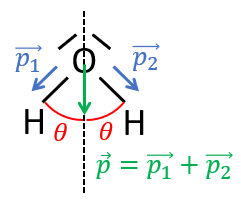
Considérons maintenant la molécule d'eau . L'oxygène étant plus électronégatif que l'hydrogène, chaque liaison entre et est polarisée, avec une charge partielle négative sur et une charge partielle positive sur (il y a donc deux charges partielles négatives sur ). On note et les moments dipolaires des liaisons :
Les liaisons étant identiques, les moments dipolaires ont la même norme : .
La molécule de étant coudée, les vecteurs et n'ont pas la même direction et leur somme ne peut donc pas s'annuler. Soit l'angle d'ouverture entre les deux atomes (). La somme vectorielle des moments dipolaires vaut :
, de norme .
Remarque : il existe une autre manière de définir la polarité d'une molécule grâce au concept du barycentre des charges partielles (le terme "barycentre" pouvant être vu comme une généralisation de la notion de centre de gravité vue pour un triangle) :
Une molécule est polaire si elle possède des liaisons polarisées ET si le barycentre des charges partielles positives (noté ) n'est pas confondu avec le barycentre des charges partielles négatives (noté ) ;
Une molécule est apolaire si elle possède des liaisons pas ou peu polarisées OU si le barycentre des charges partielles positives (noté ) est confondu avec le barycentre des charges partielles négatives (noté ).
A retenir :
Quel que soit le concept utilisé, on retiendra donc que le caractère polaire ou apolaire d'une molécule est dû à la polarisation de ses liaisons et à sa géométrie.
IV. Influence de la polarité sur les propriétés physico-chimiques d'une molécule
La polarité d'une molécule permet d'expliquer des propriétés macroscopiques d'un corps pur constitué de cette molécule. Si les molécules de ce corps pur sont polaires, et donc équivalentes à des dipôles électriques, les pôles positifs vont attirer les pôles négatifs, et ce, d'autant plus que la polarité des molécules est élevée. L'organisation des molécules dans le corps pur va donc être dictée par ces interactions électriques attractives :
A l'état solide, les molécules ont une place fixe ;
A l'état liquide, les molécules bougent mais restent en contact.
Un changement d'état solide vers liquide ou liquide vers gazeux nécessite que l'énergie thermique des molécules soit suffisante pour vaincre les interactions électriques attractives dues à leur polarité. On en tire donc la règle générale suivante (propriété physico-chimique) :
Plus la polarité des molécules constituant un corps pur est forte, plus les températures de fusion et d'ébullition de ce corps pur sont élevées.
Exemple :
On donne les températures de fusion des composés suivants :
Le silane () : -185°C ;
La phosphine () : -133°C ;
Le sulfure d'hydrogène (S) : -86°C ;
Le chlorure d'hydrogène () : -30°C ;
ainsi que les électronégativités des atomes intervenant dans ces composés (selon l'échelle de Pauling) :
: 2,20 ;
: 1,90 ;
: 2,19 ;
: 2,58 ;
: 3,16.
On se propose d'expliquer les différences entre les températures de fusion de ces quatre composés faisant intervenir l'hydrogène en se basant sur la polarité de celles-ci.
Le silane , analogue structurel silicié du méthane , a la même géométrie en , c'est-à-dire une géométrie tétraédrique. Bien que les liaisons soient polarisées, étant plus électronégatif que Si (2,20 > 1,90), la somme vectorielle des moments dipolaires des 4 liaisons est nulle à cause de la géométrie de la molécule. est donc apolaire. L'énergie thermique nécessaire pour faire passer le silane à l'état liquide est donc faible, d'où la température de fusion basse de -185°C.
La phosphine a la même géométrie en que l'ammoniac , c'est-à-dire une pyramide à base triangulaire. Les liaisons étant polarisées, elles ont chacune un moment dipolaire non nul et la somme vectorielle de ceux-ci ne s'annule pas (celle-ci est en effet un vecteur porté par la droite passant par le sommet de la pyramide et le centre de gravité du triangle formé par les 3 atomes ). La molécule de phosphine est donc polaire, mais très faiblement, car les liaisons sont peu polarisées, et ayant des électronégativités très proches (2,19 et 2,20). Par conséquent, la phosphine a une température de fusion basse également (-133°C), mais plus haute que celle du silane.
Le sulfure d'hydrogène a la même géométrie en que l'eau , c'est-à-dire une géométrie coudée. Les liaisons étant polarisées, la molécule de sulfure d'hydrogène est, au même titre que la molécule d'eau, polaire. Ici la polarisation des liaisons est beaucoup plus forte que pour les liaisons de la molécule de , la différence d'électronégativité entre et étant significative (2,58 et 2,20). La molécule de a donc une polarité plus forte que la molécule de et une température de fusion plus élevée (-82°C).
Le chlorure d'hydrogène a une géométrie linéaire (molécule ne comportant que deux atomes). La liaison est fortement polarisée à cause de la grande différence d'électronégativité entre et (3,16 et 2,20), ce qui aboutit à une molécule de chlorure d'hydrogène encore plus polaire que la molécule de sulfure d'hydrogène. On a alors une température de fusion encore plus grande (-30°C).
= Merci à athrun pour avoir contribué à l'élaboration de cette fiche =