Certains composés solides présentent des formes régulières tels que le chlorure de sodium ou le sucre.
C'est l'abbé René Just Haüy qui fut le premier à penser que la régularité des formes du cristal était la conséquence d'un arrangement des composants du cristal (atomes, ions ou molécules).
I. Cohésion des solides ioniques
1. Structure
Définition :
Un solide ionique, appelé également solide ionique cristallin ou encore cristal ionique, est une espèce chimique constituée d'un empilement compact régulier (= ordonné dans l'espace) d'anions (= ions négatifs) et de cations (= ions positifs) en nombre tel que la neutralité électrique du cristal est assurée.
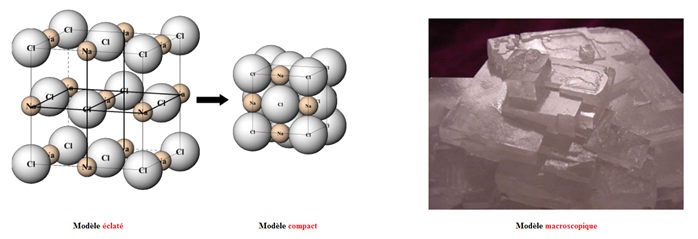
Le solide ionique peut être représenté sous différente manières : le modèle éclaté, le modèle compact et le modèle macroscopique.
Illustration des 3 modèles pour un solide ionique (d'après theo.ism.u-bordeaux.fr)
2. Cohésion
Deux particules portant respectivement une charge électrique et exercent l'une sur l'autre :
Des forces répulsives pour des charges de même signe, de même valeur,
Des forces attractives pour des charges de signes contraires, également de même valeur.
Pour plus d'information sur la loi de Coulomb, se référer à la fiche suivante : Les interactions fondamentales.
Remarque : les forces d'interaction électrostatique peuvent également être appelées interactions coulombiennes.
Nous avons vu précédemment qu'un solide ionique est constitué d'un arrangement régulier de cations et d'anions.
Ainsi, les ions présents dans un solide ionique exercent les uns sur les autres des forces d'interaction électrostatique (interactions coulombiennes).
Si les deux charges sont de même signe alors elles vont se repousser et si les charges sont de signes contraires alors les charges vont s'attirer.
En vertu de la loi de Coulomb, la valeur de la force d'attraction ou de répulsion est plus forte si les ions sont plus proches, plus faible dans le cas contraire.
Les interactions coulombiennes sont donc à l'origine de la cohésion des ions dans le solide ionique.
Propriété :
Les forces électrostatiques attractives exercées entre les cations et les anions l'emportent sur les forces répulsives entre anions ou entre cations : ces interactions sont responsables de la cohésion du solide ionique.
Afin d'avoir des interactions attractives, la structure du cristal ionique est telle :
Qu'un ion de charge négative s'entoure toujours d'ions de charge positive
Et qu'un ion de charge positive s'entoure toujours d'ions de charge négative.
Définition :
La formule statistique du solide ionique indique la nature et la proportion de chaque ion à l'intérieur du cristal.
Remarque importante : un solide ionique est électriquement neutre en vertu du principe de Lavoisier : l'arrangement du cristal est tel que les charges positives et négatives doivent se compenser.
Exemples :
Le chlorure de sodium a pour formule statistique : l'ion sodium (portant charge positive) est compensé par l'ion chlorure (portant charge négative) ;
Le permanganate de potassium a pour formule statistique : l'ion potassium (portant charge positive) est compensé par l'ion permanganate (portant charge négative) ;
Le fluorure de calcium a pour formule statistique : l'ion calcium (portant charges positives) est compensé par ions fluorure (portant chacun charge négative).
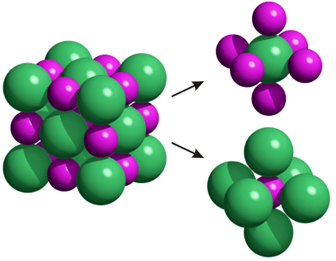
II. Cohésion des solides moléculaires
1. Notions d'électronégativité et de polarité
Ces notions sont abordées en détail dans la fiche suivante :
Electronégativité, liaison polarisée et polarité d'une molécule
2. Interaction de Van der Waals
Définition :
Les interactions de Van der Waals sont des interactions entre dipôles électriques.
Propriété :
La cohésion d'un solide moléculaire est assurée par les interactions de Van der Waals qui sont des interactions électrostatiques le plus souvent attractives :
Si la molécule est polaire, les dipôles s'orientent de manière à ce que l'interaction soit attractive ;
Si la molécule est apolaire, le nuage électronique a la capacité de se déformer et ainsi faire apparaître un dipôle instantané donnant lieu à une interaction attractive.
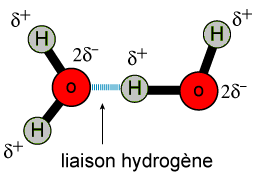
3. Liaison hydrogène (ou pont hydrogène)
Définition :
Une liaison hydrogène, ou pont hydrogène, est une interaction électrostatique attractive entre un atome d'hydrogène, lié à un atome très électronégatif, et un atome d'une autre molécule, très électronégatif et porteur d'un doublet non liant.
Les molécules qui possèdent des atomes d'hydrogène impliqués dans des liaisons polarisées ont la capacité d'établir des liaisons hydrogène.
Ces liaisons sont des interactions intermoléculaires entre un atome d'hydrogène et un autre atome d'une autre molécule plus électronégatif, le plus souvent l'oxygène , l'azote , le fluor ou le chlore .
En conséquence, toutes les molécules appartenant à la famille des alcools présentent des liaisons hydrogène.
Les liaisons hydrogène sont des interactions attractives, plus fortes que les liaisons de Van der Waals.
Remarque : les liaisons hydrogène créées entre les molécules d'eau ont une conséquence importante : l'eau liquide est plus compacte que l'eau solide, ce qui n'est pas le cas pour les autres corps purs.
= Merci à gbm / Skops pour avoir contribué à l'élaboration de cette fiche =