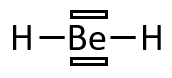I. Rappel sur la représentation de Lewis d'une molécule
Représentation de Lewis :
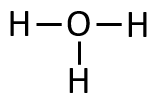
La représentation de Lewis d'une molécule est une représentation bidimensionnelle de la configuration électronique externe (valence) de celle-ci. Elle fait apparaître tous les atomes de la molécule ainsi que tous les électrons de valence sous la forme de doublets liants et de doublets non liants.
Voir la fiche : De l'atome vers des entités plus stables chimiquement : les molécules et les ions où l'exemple de la molécule de dichlore Cl est donné.
En plus des molécules, les ions polyatomiques ont aussi une représentation de Lewis.
II. Représentation de Lewis d'une molécule ou d'un ion polyatomique
1. Méthode permettant d'obtenir la représentation de Lewis d'une molécule ou d'un ion polyatomique
On donne ici une méthode permettant d'obtenir la représentation de Lewis d'une molécule ou d'un ion polyatomique :
Écrire la configuration électronique de valence de chaque atome.
Pour un atome donné, on note son nombre d'électrons de valence quand il est isolé (c'est-à-dire pas en tant que membre de l'entité finale qu'on souhaite représenter). On note la charge de l'entité :
dans le cas d'un cation ;
dans le cas d'un anion ;
dans le cas d'une molécule.
Le nombre total d'électrons de valence de l'entité vaut alors :
L'entité peut former doublets au total (liants et non liants).
Réaliser l'enchaînement des atomes permettant de placer tous les doublets liants en respectant la valence des atomes.
Compléter avec les doublets non liants pour que les atomes satisfassent à la règle de l'octet (ou du duet pour ).
Calculer les charges formelles sur chaque atome. Soit la charge formelle d'un atome donné dans l'entité. On a , où :
est le nombre d'électrons de valence de l'atome isolé ;
est le nombre d'électrons entourant l'atome quand il est lié à d'autres atomes dans l'entité. Un doublet liant compte pour 1 électron et un doublet non liant compte pour 2 électrons.
Vérifier qu'on a bien .
Si plusieurs représentations de Lewis ont été ainsi obtenues, on choisit la plus plausible sur la base d'arguments électrostatiques :
Le moins de charges formelles possible ;
Charges formelles de même signe les plus éloignées possible.
Pour aller plus loin (hors programme) : dans la méthode ci-dessus, si est impair, il existe un ou plusieurs électrons célibataires dans l'entité. Tous les atomes constituant l'entité ne respectent pas la règle de l'octet : ce sont les limites de la théorie de Lewis. Ces limites seront davantage explicitées dans les études supérieures.
2. Exemple de l'ion polyatomique
L'atome a pour configuration électronique () et l'atome a ().
Cet ion a une charge "" donc . On en déduit le nombre total d'électrons de valence de l'entité : .
Le nombre total de doublets dans l'ion oxonium est donc .
Chaque atome d'hydrogène peut former une liaison covalente :
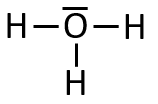
Avec leurs doublets liants, chaque atome respecte la règle du duet. L'atome est entouré de électrons, il lui en manque pour respecter l'octet. On lui ajoute donc un doublet non liant (pour atteindre ) :
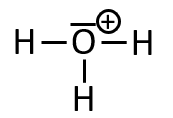
Avec la représentation ci-dessus, chaque atome d'hydrogène a un (un seul doublet liant) et l'atome d'oxygène a un (3 doublets liants et un doublet non liant qui compte pour électrons). Cela nous permet de calculer les charges formelles sur chaque atome. Pour l'atome on a et pour l'atome on a . Il faut donc placer une charge positive sur l'atome , qui correspond au "" dans l'ion polyatomique .
D'autre part, on a bien .
Ici il n'y a pas d'autre représentation de Lewis possible pour l'ion .
Ceci n'est pas toujours le cas : par exemple, pour la molécule de dioxyde de soufre , on trouve trois représentations de Lewis possibles, dont une sans charges formelles plus probable que les autres, qui elles ont des charges formelles.
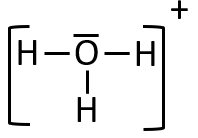
Finalement, la représentation de Lewis de l'ion oxonium est comme suit (on ne fait pas apparaître les charges formelles, seulement la charge totale de l'ion, qu'on aura placée à l'extérieur de crochets) :
III. Lacune électronique
En réalité, le duet et l'octet ne sont pas toujours atteints. Par exemple, le beryllium Be, de numéro atomique (2ème colonne du tableau périodique, famille des alcalino-terreux), a une valence en 2s. Il n'a donc pas d'électron célibataire pouvant être engagé dans une liaison covalente, les électrons de sa sous-couche 2s étant appariés.
Cependant, on peut imaginer un état excité de l'atome où ses électrons de valence se situeraient sur des sous-couches différentes et où l'atome aurait une valence en 2s2p (un électron de la sous-couche 2s a migré sur la sous-couche 2p en gagnant de l'énergie). Dans cet état, le béryllium a deux électrons célibataires qui lui permettent de former deux liaisons covalentes. En les réalisant, il serait entouré par 4 électrons, il lui en manquerait donc encore 4 pour atteindre l'octet. Les deux paires d'électrons qui lui manquent sont appelées lacunes électroniques et sont représentées par des cases vides :
Définition :
Une lacune électronique correspond à une paire d'électrons en moins par rapport aux règles du duet et de l'octet.
Un autre exemple peut être donné avec l'ion de valence . Cet ion n'a plus d'électron, il présente un déficit électronique par rapport à la règle du duet. La paire d'électrons qui lui manque pour atteindre le duet est ici aussi représentée par une case vide indiquant une lacune électronique.
IV. Prévision de la géométrie des molécules et des ions polyatomiques
1. Théorie VSEPR
L'acronyme anglais VSEPR signifie Valence Shell Electron Pairs Repulsion, soit répulsion des paires d'électrons de la couche de valence. La théorie VSEPR (aussi appelée théorie de Gillespie) permet de connaître la géométrie d'une entité polyatomique en connaissant sa représentation de Lewis. Elle repose sur le fait que la géométrie d'une telle entité est imposée par le nombre de doublets d'électrons qui entourent un atome central noté . Ces paires d'électrons, qu'elles soient liantes ou non liantes, se repoussent (forces coulombiennes répulsives). La géométrie adoptée par l'entité est alors celle minimisant les répulsions électroniques. Les distances entre les différents doublets doivent donc être maximales.
On note les voisins de l'atome central et leur nombre. On note le nombre de paires non liantes (notées ) qui entourent . On peut décrire l'environnement de l'entité chimique par la formule . C'est alors la valeur qui déterminera la géométrie de la molécule. Avoir écrit la formule de Lewis au préalable est donc indispensable pour déterminer la géométrie d'une molécule.
Exemple :
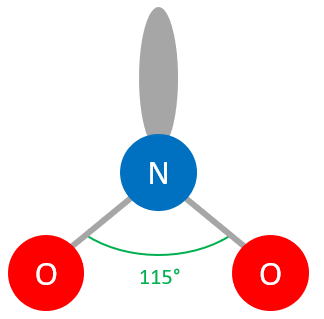
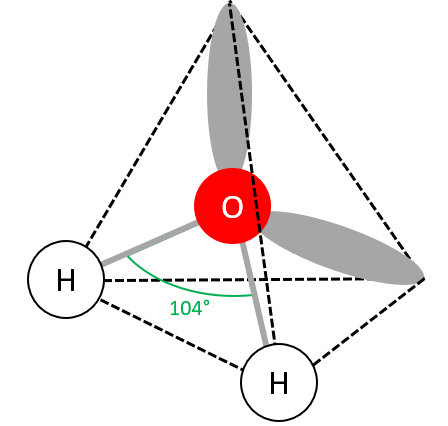
La molécule d'HO est donc de la forme AXE : l'atome central est O, les atomes voisins sont les deux atomes H et il y a deux paires non liantes (doublets non liants) entourant O.
2. Différentes géométries
On retiendra les géométries suivantes :
Ces géométries doivent ensuite être déclinées suivant le nombre de voisins et le nombre de paires d'électrons non liantes . Les doublets non liants ne sont pas représentés par des tirets (mais par des sortes de bulles allongées) car ils sont moins localisés que les doublets liants.
Les entités polyatomiques comportant deux atomes ont une géométrie linéaire (, , ).
3. Exemples
: géométrie linéaire () :
:
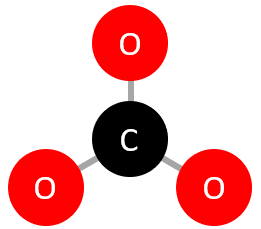
géométrie trigonale plane () :
géométrie coudée () :
:
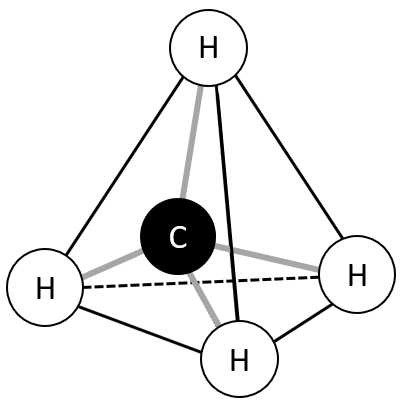
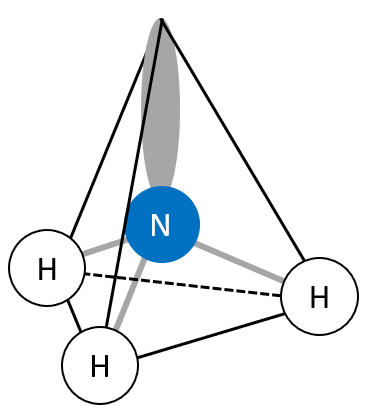
tétraèdre () :
pyramide à base triangulaire () :
géométrie coudée () :
Etc.
4. Autres représentations spatiales
Pour tenir compte de la disposition spatiale des liaisons d'une molécule ou d'un ion polyatomique, la représentation de Cram (moins complète que la théorie VSEPR) peut également être utilisée en classe de première. On indique alors :
Par un trait les liaisons situées dans le plan de la feuille ;
Par un triangle plein celles situées en avant du plan ;
Par un triangle hachuré celle situées en arrière du plan.
Pour aller plus loins (hors programme) : il existe d'autres types de représentations comme par exemple la représentation de Fisher ou la représentation de Haworth qui sont utilisées pour étudier les molécules cycliques comme les glucides, ou la représentation de Newman qui est une projection.
= Merci à athrun pour avoir contribué à l'élaboration de cette fiche =