I. La mole, unité de la quantité de matière
1. Introduction
Définition :
Une entité chimique est une appellation générique se référant :
Soit à un atome ;
Soit à une molécule ;
Soit à un ion ;
Etc.
Une espèce chimique est un ensemble d'entités chimiques (atomes, molécules ou ions) identiques.
Un échantillon est une quantité finie d'espèces chimiques ; cette quantité est utilisée pour représenter et étudier les propriétés de cet ensemble.
2. Mesurer des quantités d'entités chimiques dans un échantillon
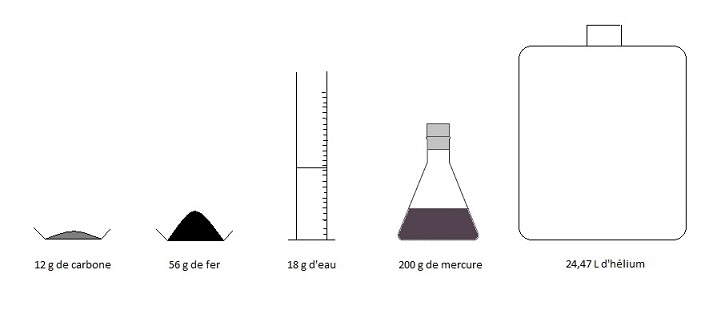
Quel est le point commun entre les échantillons de chaque récipient ci-dessous ?
Ces récipients de masses différentes contiennent pourtant le même nombre d'entités chimiques : environ milliards de milliards !
On constate dès lors que des masses pas si élevées conduisent à un nombre d'atomes, de molécules ou d'ions très important ! Pour quantifier ces constituants, il est donc préférable de regrouper ces constituants par paquets. Ainsi, plutôt que de parler du nombre d'atomes, de molécules ou d'ions, on préfère introduire une unité plus adaptée.
Autrefois, on prenait comme unité le nombre d'atomes contenus dans d'hydrogène (le plus léger des atomes). Pour une question de précision, on a par la suite modifié cette définition en considérant le nombre d'atomes contenus dans exactement de carbone noté .
3. La mole, unité de référence
Définition :
La mole, de symbole , est l'unité de la quantité de matière.
Une mole contient exactement entités élémentaires.
Ce nombre, appelé « nombre d'Avogadro », correspond à la valeur numérique fixée de la constante d'Avogadro, notée , lorsqu'elle est exprimée en :
Conséquence : cette unité de référence permet donc de passer aisément du niveau microscopique (nombre d'atomes, de molécules ou d'ions) au niveau macroscopique (mole d'atomes, de molécules ou d'ions) dans lequel le chimiste peut quantifier les masses et les volumes correspondants.
II. Quantité de matière d'une espèce chimique
Définition :
La quantité de matière, de symbole , est une représentation du nombre d'entités élémentaires (atomes, molécules, ions, ...) présentes dans un échantillon.
Si l'échantillon est constitué de entités chimiques (pas d'unité), alors sa quantité de matière (en mol) vaut :
III. Application aux mesures expérimentales
Définition :
Considérons un échantillon de masse . Chaque entité (atome, molécule ou ion) contenue dans cet échantillon a une masse .
Le nombre d'entités chimiques présentes dans l'échantillon vaut :
Ainsi, la quantité de matière peut s'exprimer de la façon suivante :
Remarque :
et doivent être exprimées dans la même unité de masse ( ou ...) pour garantir l'homogénéité de la formule !
La masse d'une molécule est égale à la somme des masses des atomes qui constituent cette molécule ;
La masse d'un ion est - en première approche - sensiblement égale à celle de l'atome ou de la molécule correspondante (la masse des électrons étant négligeable devant celle des protons et des neutrons du noyau d'un atome) réviser la fiche suivante :
= Merci à lulu3324 pour avoir contribué à l'élaboration de cette fiche =