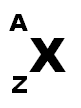I. La fabuleuse histoire de l'atome
1. Les atomes de Démocrite et les atomes de Dalton
Dès l'Antiquité, des philosophes grecs considéraient que la nature des choses s'expliquait par le mélange de 4 éléments : le feu, l'eau, la terre et l'air.
Au 4e siècle avant notre ère, le philosophe Démocrite ( av. J-C) pense que la matière est formée de grains indivisibles : les atomes (du grec atomos : "qu'on ne peut pas diviser"). En effet, Démocrite pense que les atomes sont pleins mais tous différents (certains crochus, ronds, etc.), de manière à pouvoir les emboîter ensemble (provenance de l'expression "avoir des atomes crochus avec quelqu'un", qui signifie : bien s'entendre avec cette personne). Malheureusement, Démocrite n'a aucune preuve expérimentale et sa démarche n'est que philosophique.
Le philosophe grec Aristote ( av. J-C) rejette cette théorie et reprend l'idée des 4 éléments : c'est sur cette fausse idée que vont reposer les travaux des alchimistes pendant plus de siècles !
Ce n'est qu'au 19e siècle que la théorie de Démocrite sera reprise comme hypothèse par le britannique John Dalton ().
En , il suppose l'existence des atomes et déclare qu'ils en existent plusieurs types, mais tout comme Démocrite, il n'a pas de preuve expérimentale.
En , il propose la première liste de symboles représentant les différents atomes.
2. L'expérience de William Crookes
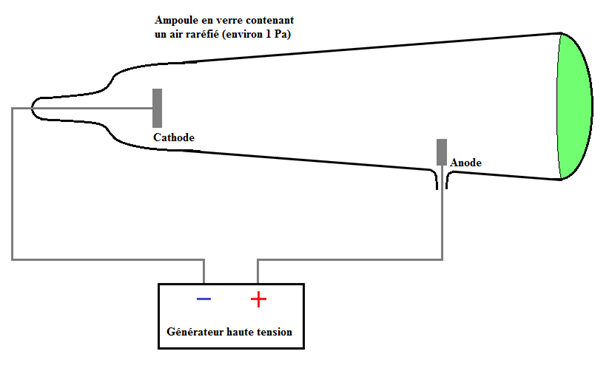
En , le Britannique William Crookes () réalise une expérience importante sur les atomes :
Il utilise un tube en verre (aujourd'hui ce tube en verre est appelé tube de Crookes) dans lequel l'air est raréfié (la pression est faible, environ ).
Il place dans ce tube électrodes, entre lesquelles il applique une tension d'environ volts.
Il observe alors que pour une pression faible, un rayonnement issu de la cathode et provoquant une luminescence sur les parois du tube.
Il donne à ces rayonnements le nom de "rayonnements cathodiques".
Il montre que ces rayons sont électriquement chargés car ils sont déviés par le champ magnétique d'un aimant.
En , le Britannique Joseph John Thomson () prouve que ces "rayons cathodiques" sont des courants de particules portant une charge négative. Dans le tube de Crookes, ces particules sont arrachées à la cathode.
3. Modèles de l'atome de Rutherford, de Bohr et de Schrödinger
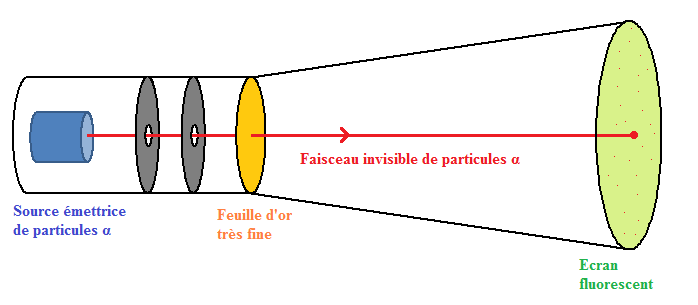
En , la structure de l'atome reste dans le domaine des hypothèses. Le physicien Britannique Ernest Rutherford () réalise une expérience décisive :
Il bombarde une feuille d'or très fine de particules alpha émises par un corps radioactif.
Les particules alpha sont des atomes d'hélium ayant perdu électrons.
Elles sont beaucoup plus petites que les atomes d'or.
Rutherford considère que la feuille d'or est constituée d'environ couches parallèles d'atomes.
Il observe que seule une infime minorité de particules alpha semble rebondir sur la feuille d'or : sur .
La grande majorité de ces particules alpha ne sont pas déviées par la traversée de la feuille.
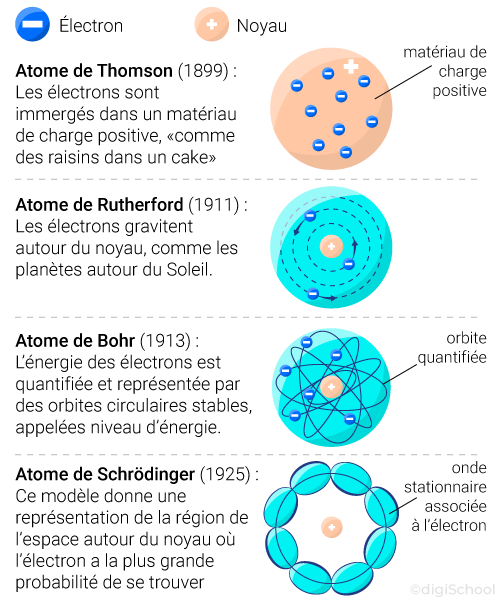
En , il compare l'atome avec le système solaire ; l'atome est constitué d'un noyau autour duquel gravitent les électrons. Il propose un modèle de l'atome (appelé "aspect lacunaire de l'atome").
En , Niels Bohr () propose un nouveau modèle d'atome : les orbites des électrons ne sont pas quelconques mais "quantifiées" ; seules certaines orbites particulières sont permises pour l'électron. Ce n'est que lorsque celui-ci saute d'une orbite à l'autre qu'il peut émettre (ou absorber) de la lumière.
Depuis, d'autres modèles plus complexes ont été élaborés, non plus sur la base de la physique classique mais sur la base de la physique quantique ! En effet, s'inspirant des travaux du physicien français Louis de Broglie, Erwin Schrödinger (), propose un nouveau modèle de l'atome dans lequel les électrons ne décrivent plus des orbites mais sont contenus dans un nuage électronique, zone de forte probabilité de présence (ou "orbitales"). C'est le modèle actuel de l'atome.
Schéma bilan de l'évolution des modèles de l'atome
(d'après blog.univ-angers.fr)
II. Structure et caractéristiques de l'atome et de son noyau
1. Dimensions de l'atome et de son noyau
Le modèle de l'atome qui sera considéré est celui d'un noyau central autour duquel gravitent des électrons constituant un nuage électronique.
Définitions :
Les ordres de grandeur de l'atome sont les suivants :
Rayon de l'atome : ;
Rayon du noyau : ;
Comparaison :
le noyau de l'atome est donc fois plus petit que l'atome ! On dit qu'il est lacunaire (c'est-à-dire constitué essentiellement de vide).
2. Constituants de l'atome et de son noyau
Le noyau d'un atome est constitué :
De protons chargés positivement, de charge électrique élémentaire (coulomb) ;
De neutrons électriquement neutres ;
Protons et neutrons constituent ce qu'on appelle les nucléons.
Les protons et les neutrons ont des masses peu différentes :
Masse proton : ;
Masse neutron : ;
On peut donc considérer, en première approche que :
Outre son noyau, l'atome est constitué d'un nuage d'électrons gravitant autour :
Ils sont chargés négativement, de charge électrique élémentaire ;
Leur masse vaut , soit environ fois plus petite que celle d'un nucléon !
Approximation :
Donner la masse approchée d'un atome revient à négliger la masse de ses électrons devant celle des nucléons (protons et neutrons).
3. Représentation symbolique du noyau d'un atome
Symbole de l'atome :
De manière générale, on symbolise le noyau d'un atome de la façon suivante :
représente le symbole de l'élément chimique considéré ;
, appelé numéro atomique (ou nombre de charges), constitue le nombre de protons ;
, appelé nombre de masse, constitue le nombre de nucléons (protons + neutrons).
Remarque importante : connaissant le numéro atomique () et le nombre de masse (), on en déduit le nombre de neutrons :
4. Electroneutralité de l'atome
Propriété :
Un atome est électriquement neutre : il contient autant de protons (chargés positivement) dans son noyau que d'électrons (chargés négativement) dans son nuage électronique.
Rappel important : les neutrons (comme son nom l'indique) n'ont pas de charge ! Ils sont électriquement neutres.
5. Noyaux isotopes
Définition :
Deux noyaux isotopes ont le même nombre de proton(s) (ou le même numéro atomique ou le même nombre de charge) mais des nombres différents de neutrons, donc des nombres de masse différents :
III. Exemple d'application : autour de l'uranium
1. Enoncé
Partie I. Abondance de l'uranium sur Terre
L'uranium , de symbole , est le 48e élément naturel le plus abondant dans la croûte terrestre. Son abondance est supérieure à celle de l'argent, comparable à celle du molybdène ou de l'arsenic, mais quatre fois inférieure à celle du thorium. Il se trouve partout à l'état de traces, y compris dans l'eau de mer. C'est un métal lourd radioactif, dont la période est très longue (environ milliards d'années, ce qui s'apparente à l'âge de la Terre !). Les principaux producteurs mondiaux sont le Kazakhstan (), le Canada (), l'Australie (), le Niger (), la Russie (), la Namibie () et l'Ouzbékistan ().
a. Déterminer les constituants de ce noyau d'uranium.
b. En déduire la charge de son noyau.
c. Que peut-on dire de l'atome ?
d. Calculer la masse approchée de ce noyau (on prendra ).
Partie II. Intérêt de l'uranium pour l'industrie nucléaire
Le noyau d'uranium 235, de symbole , est le plus susceptible de conduire à une fission nucléaire. Celle-ci libère une énergie colossale : plus d'un million de fois supérieure à celle des combustibles fossiles pour une masse équivalente ! De ce fait, l'uranium est devenu la principale matière première utilisée par l'industrie nucléaire, bien qu'il soit moins abondant sur Terre que le noyau d'uranium ().
a. Que peut-on dire du noyau par rapport au noyau ? En déduire la charge du noyau .
b. Déterminer la masse approchée du noyau .
c. Sachant que , en déduire la masse de l'atome.
d. Que peut-on dire de la masse de cet atome vis-à-vis de la masse de son noyau ?
2. Correction
Partie I. Abondance de l'uranium sur Terre
Question a. En vertu de la représentation symbolique , les constituants du noyau d'uranium 238 sont les suivants :
, appelé numéro atomique (ou nombre de charges), constitue le nombre de protons ;
, appelé nombre de masse, constitue le nombre de nucléons (protons + neutrons) ;
Ainsi, le nombre de neutrons contenus dans le noyau est :
Question b. Chaque proton porte une charge élémentaire positive valant . Ainsi, la charge totale du noyau vaut :
Question c. Par nature, l'atome est électriquement neutre, il possède donc autant de protons que d'électrons. En conséquence, la charge totale du nuage électronique vaut :
Question d. Étant donné que les protons et les neutrons ont des masses relativement proches, on considérera ici que : .
Finalement, la masse approchée du noyau d'uranium 238 vaut :
Partie II. Intérêt de l'uranium pour l'industrie nucléaire
Question a. Les noyaux d'uranium 235 et 238 possèdent le même nombre de charges mais possèdent des nombres de masse différents, ce sont donc des noyaux isotopes.
Question b. De la même manière que pour la question I.d., la masse approchée du noyau d'uranium 235 vaut :
Question c. Étant donné que l'atome possède le même nombre d'électrons que de protons, sa masse vaut :
Question d. On constate que dans la mesure où la masse des électrons contenu dans le nuage électronique est négligeable devant celle du noyau.
L'approximation consistant à ne considérer que la masse du noyau donne une bonne estimation de la masse de l'atome d'uranium.
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =