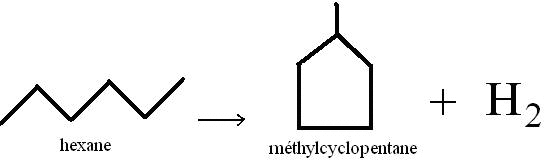I. Synthèse en chimie organique : rappels
Les notions suivantes ont été introduites en classe de 1re :
Synthèse d'une espèce chimique organique ;
Protocole expérimental de synthèse en chimie organique : transformation, séparation, purification et identification ;
Rendement d'une synthèse.
Il est donc fortement recommandé de réviser la fiche suivante :
Synthèses d'espèces chimiques organiques
II. Optimisation d'une étape de synthèse : estérification, hydrolyse et saponification
1. Synthèse d'un ester (ou estérification)
Définition :
La synthèse d'un ester (ou estérification) résulte de l'action d'un acide carboxylique sur un alcool, donnant un ester et de l'eau.
Son équation-bilan est :
Propriétés :
L'estérification est une transformation lente, athermique et limitée ; elle conduit à un état d'équilibre.
Cette réaction peut être catalysée par l'ajout d'acide sulfurique.
Exemple : la réaction entre l'acide éthanoïque et le propanol s'écrit :
+ +
Équilibre de la réaction :
Les réactifs utilisés sont des produits purs.
L'eau n'est pas un solvant dans cette réaction, donc il doit apparaître dans l'écriture de la constante d'équilibre :
Rendement :
Le rendement d'une réaction d'estérification (dans de bonnes conditions) est de :
Le rendement de la réaction d'estérification entre un acide carboxylique et un alcool dépend de la classe de l'alcool utilisé. Pour un alcool primaire, le rendement se situe autour de . Il est d'environ pour un alcool secondaire et pour un alcool tertiaire.
2. Hydrolyse d'un ester
Définition :
Une hydrolyse est une réaction chimique au cours de laquelle il y a rupture de liaison par l'eau.
Ainsi, au cours de l'hydrolyse d'un ester, la liaison est rompue par l'eau et conduit à la formation d'acide carboxylique et d'alcool : l'hydrolyse est la réaction inverse de l'estérification.
Son équation-bilan est :
Propriétés :
L'hydrolyse est donc une réaction lente, limitée par sa réaction inverse (ceci explique que le système chimique évolue vers un état d'équilibre dynamique), et athermique (elles ne nécessitent pas d'apport d'énergie thermique pour se produire et ne dégagent pas d'énergie thermique).
Exemple : l'hydrolyse du butanoate de méthyle donne de l'acide butanoïque et du méthanol :
+ +
Équilibre de la réaction :
Rendement :
3. Équilibre d'estérification-hydrolyse
À l'équilibre, les deux transformations se compensent parfaitement : les réactions n'étant pas totales, les vitesses de réaction de l'estérification et de l'hydrolyse sont égales. L'état d'équilibre est la situation pour laquelle la vitesse de la réaction d'estérification est la même que la vitesse d'hydrolyse de l'ester formé. L'acide, l'alcool, l'ester et l'eau coexistent.
Catalyse et montage à reflux :
On peut atteindre plus rapidement l'état d'équilibre sans modifier sa composition en utilisant un catalyseur ( catalyse l'estérification et l'hydrolyse) ou en chauffant à reflux le mélange réactionnel.
Il permet de synthétiser plus rapidement un produit. Le réfrigérant placé au-dessus du ballon permet de condenser les gaz volatils et d'éviter de perdre les composés du milieu réactionnel.
Pour assécher un milieu, on utilise des sels anhydres (de magnésium ou de calcium ).
Pour vérifier la pureté d'un produit, on peut effectuer une (Chromatographie sur Couche Mince).
Déplacement d'équilibre de la réaction d'estérification ou d'hydrolyse :
On peut déplacer l'état d'équilibre vers une plus grande formation de l'ester en éliminant l'un des produits à mesure qu'il se forme. On utilise pour cela des procédés tels que la distillation ou l'hydrodistillation (entraînement à la vapeur).
La distillation est une opération qui consiste à porter à ébullition un mélange et à en condenser la vapeur dans le but de séparer ou de purifier les constituants d'un mélange.
Pour déplacer l'équilibre d'une réaction, on peut également ajouter en excès l'un des deux réactifs. La réaction ne sera jamais totale, néanmoins, on augmente le rendement de la réaction.
Généralement, le réactif ajouté en excès est le moins coûteux.
Exemples :
Estérification classique : moles d'alcool réagissant avec une mole d'acide permettront de former la même quantité d'ester et d'eau, mais le rendement sera de à (au lieu de ).
Hydrolyse classique : 3 moles d'eau réagissant avec une mole d'ester formeront un alcool et un acide avec un rendement de 40 à 45 % (au lieu de 33 %).
La réaction d'estérification étant en équilibre avec la réaction d'hydrolyse, pour obtenir une réaction d'estérification totale, il ne faut pas produire d'eau.
Pour ce faire, on remplace l'acide carboxylique par un anhydride d'acide ou un chlorure d'acyle.
L'action d'un chlorure d'acyle ou d'un anhydride d'acide sur un alcool donne un ester, et la transformation est rapide et totale.
R-COCl (chlorure d'acyle) + R'-OH (alcool) (ester) +
(anhydride d'acide) + + (acide carboxylique)
Remarque : il n'y a plus d'eau dans le milieu donc pas de réaction d'hydrolyse avec l'anhydride d'acide ou le chlorure d'acyle.
Exemple :
Anhydride éthanoïque + éthanol = éthanoate d'éthyle + acide éthanoïque
+ +
3. Hydrolyse basique d'un ester : cas des savons
Définition :
L'hydrolyse basique d'un ester (saponification) est l'action des ions hydroxyde sur un ester. Il se forme un ion carboxylate et un alcool .
Remarque : les ions hydroxyde sont apportés par une base forte telle que la soude ou la potasse .
La saponification est une réaction assez rapide et totale ().
Remarque : à chaud, la réaction de saponification est une réaction rapide.
Le bilan de cette réaction est :
Définition des corps gras :
Les corps gras sont essentiellement constitués de triglycérides, c'est-à-dire qu'ils contiennent dans la même molécule trois fonctions ester.
Les acides gras sont des acides carboxyliques dont la chaîne carbonée, non ramifiée, a un nombre pair d'atomes de carbone (4 à 22).
Les corps gras sont des triesters du glycérol (propan-1,2,3-triol) et d'acides gras :
Leur hydrolyse basique à chaud permet de récupérer le triol (glycérol) et le savon :
Un savon est un mélange de carboxylates + , dérivés d'acides gras ; est ou (suivant l'utilisation de soude ou de potasse). Après précipitation adéquate, un solide de formule ou forme le savon (on effectue un relargage).
Propriétés des corps gras : ces dernières ont été vues en 1re dans la fiche suivante :
Solubilité et miscibilité d'espèces chimiques
III. Modifications du squelette carboné
1. Les réactions de substitution
La réaction de substitution consiste à remplacer un atome ou d’un groupe d’atomes sur une molécule organique.
2. Les réactions d'élimination
La réaction d'élimination consiste à retirer un atome ou d’un groupe d’atomes sur une molécule organique.
3. Les réactions d'addition
La réaction d'addition consiste à ajouter un atome ou d’un groupe d’atomes sur une molécule organique.
Dans ce type de réaction, la double liaison plane est remplacée par une liaison simple.
L'atome de carbone est alors tétraédrique et le nombre d'atomes de carbone composant la chaîne carboné n'est pas modifié.
Deux substituants vont se fixer sur le réactif insaturé de la réaction. Ces substituants sont issus de la scission en deux parties de la molécule d'un autre réactif.
Exemple : en présence d'un catalyseur, sous pression et à chaud :
+
est le réactif insaturé et le dihydrogène est la molécule se coupant.
4. La polymérisation (ou polyaddition)
La polymérisation est une technique consistant en une addition répétée d'un très grand nombre de molécules insaturées appelées monomères. Cette opération conduit à la formation d'une macromolécule appelée polymère :

Le groupe est le motif du polymère.
Les monomères peuvent être des composés vinyliques du type suivant : . Ils présentent alors un groupe vinyle : .
Les polymères résultants seront donc de la forme : .
Exemples :
L'éthylène conduit à la formation du polyéthylène () servant à la fabrication des emballages d'aliments, films plastiques, flacons, bidons, etc.
Le chlorure de vinyle à pour polymère correspondant le polychlorure de vinyle () utilisé entre autres pour les tuyaux et les canalisations ;
Le styrène donnera le polystyrène () présents dans les réfrigérateurs, pour la protection des emballages, etc.
5. Exemple d'application : synthèse multi-étapes intervenant dans le raffinage des pétroles
Ces réactions sont utilisées afin de valoriser les produits résultant de la distillation fractionnée des pétroles. Il s'agit d'un exemple industriel qui n'est pas à connaître par cœur.
Selon la température, le pétrole emmagasiné n'est pas transformé de la même manière. Il existe alors une sorte d'échelle de distillation.
Les différents hydrocarbures contenus dans le pétrole sont séparés dans des raffineries par distillation fractionnée : le pétrole est chauffé jusqu'à . Les composés organiques gazeux à faibles températures d'ébullition sont évacués en haut de la colonne. Les composés au squelette carboné plus important, qui ont une grande température d'ébullition, sont récupérés en bas de la colonne.
Le craquage thermique est une opération au cours de laquelle les molécules d'hydrocarbures saturés à longues chaînes sont cassées par l'agitation thermique pour produire des molécules à chaînes plus courtes.
Il existe plusieurs types de craquage :
Le craquage catalytique : se produit en présence d'un catalyseur (une substance accélérant la réaction sans subir de modifications permanentes et sans influer sur le bilan de la réaction) ;
Le vapocraquage (ou hydrocraquage) : la rupture des molécules se fait en présence de vapeur d'eau.
Exemples :
Le craquage de l'hexane : ici, l'hexane initial a été brisé en deux parties : du but-1-ène et de l'éthane. En additionnant ces deux nouveaux hydrocarbures, on retrouve de l'hexane :
Le craquage de butane : de la même manière, on obtient :
Sous l'action de la chaleur et de catalyseurs, le reformage est une opération au cours de laquelle des chaînes linéaires vont pouvoir être transformées soit en chaînes cyclisées et déshydrogénées, soit en chaînes ramifiées, qui conduisent à des cycles insaturés comportant une ou plusieurs liaisons multiples.
Techniques ne modifiant pas le nombre de carbones :
a) Isomérisation et ramifications du squelette carboné :
Dans cette transformation s'effectuant à températures modérées (de l'ordre de à ), on aboutit à une molécule ramifiée à partir d'une molécule linéaire.
Exemple de l'hexane :
b) La déshydrogénation :
On réalise l'élimination d'un atome d'hydrogène porté par chaque atome de carbone engagé dans la réaction.
On notera alors l'apparition d'une double liaison entre deux atomes de carbone liés par une liaison simple.
c) La cyclisation :
Cette réaction se produit dans les mêmes conditions que la précédente. Ici, on transforme un alcane linéaire en cyclane (alcane à chaîne fermée). Cependant cette réaction n'est possible que pour des alcanes possédant au moins 5 atomes de carbone.
Exemple de l'hexane :
d) La cyclisation suivie d'une déshydrogénation :
La cyclisation peut s'effectuer à des températures plus élevées, voisines de . On utilisera un catalyseur, en général du platine () : la réaction sera dans ce cas accompagnée d'une déshydrogénation et conduira à l'apparition d'un cycle benzénique.
Techniques influant sur le nombre de carbone : ces techniques allongent la chaîne carbonée.
a) L'alkylation :
Cette opération consiste à remplacer un atome d'hydrogène d'une chaîne carbonée par un groupe alkyle. Il y a possibilité de la réaliser en combinant un alcane et un alcène.
b) La polymérisation :
Il s'agit de la principale technique, et la plus courante (voir §III. 4.).
= Merci à gbm et shadowmiko pour avoir contribué à l'élaboration de cette fiche =