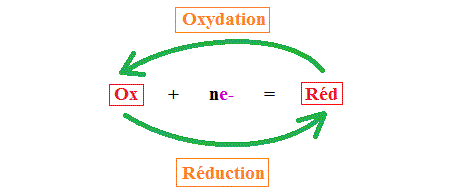
I. Notions d'oxydant et de réducteur
Définitions :
Un oxydant est une espèce chimique capable de capter un ou plusieurs électron(s), notés .
Un réducteur est une espèce chimique capable de céder un ou plusieurs électron(s), notés .
II. Les couples oxydant/réducteur
Définition :
Deux espèces chimiques forment un couple oxydant/réducteur si on peut passer de l'un à l'autre par une perte ou un gain d'un ou plusieurs électrons .
Un couple oxydant-réducteur s'écrit de la manière suivante : .
Ces deux espèces chimiques sont dites conjuguées : est l'oxydant conjugué de et est le réducteur conjugué de .
III. Demi-équation d'oxydo-réduction
Soit un couple oxydant/réducteur , on passe de l'un à l'autre par perte ou gain d'un ou plusieurs électron(s) :
Si l'oxydant est le réactif alors l'équation s'écrira : , où est le nombre d'électron(s) capté(s) ;
Si le réducteur est le réactif alors l'équation s'écrira : , où est le nombre d'électron(s) cédé(s).
IV. Réaction d'oxydoréduction
1. Définition et propriété d'une réaction d'oxydoréduction
Définition :
La réaction d'oxydoréduction est caractérisée par un transfert d'électrons par contact entre un oxydant et un réducteur de deux couples différents.
Lors d'une réaction d'oxydoréduction, il y a deux couples oxydant/réducteur qui interviennent : et .
L'oxydant d'un couple réagit avec le réducteur du deuxième couple.
On fait réagir l'oxydant avec le réducteur .
En écrivant les 2 demi-équations d'oxydoréduction, on obtient :
( est le nombre d'électron(s) capté(s)) ;
( est le nombre d'électron(s) cédé(s)).
Propriété :
Dans une réaction d'oxydoréduction, il faut que le nombre d'électron(s) cédé(s) et le nombre d'électron(s) capté(s) soit le même.
Méthode :
Si le nombre d'électrons est le même, il n'y a aucun changement à faire.
Si le nombre d'électrons dans chaque demi-équation est différent, il faut multiplier les demi-équations par un entier pour obtenir le même nombre d'électrons.
Pour ce faire, on multiplie la première équation par un entier et on multiplie la deuxième équation par un autre entier de telle sorte que le nombre d'électrons transférés soit le même dans les deux demi-équations.
L'équation de la réaction sera : .
Remarque importante : on ne fait pas figurer les électrons dans l'équation, puisqu'on a équilibré chaque demi-équation en nombre égal d'électron(s).
2. Application simple : réaction de l'aluminium dans une solution de sulfate de cuivre
On introduit des morceaux d'aluminium dans une solution de sulfate de cuivre. L'aluminium va donc réagir avec l'ion .
Les couples en présence sont et .
Les demi-équations des deux couples qui réagissent sont :
;
.
On remarque que le nombre d'électrons n'est pas le même, on va donc multiplier la première demi-équation par et la deuxième demi-équation par , on aura donc électrons :
;
.
Finalement, l'équation de la réaction sera :
3. Cas où la réaction d'oxydoréduction ne se fait pas que par un simple transfert d'électrons
Il y a des cas où trouver la demi-équation s'avère un peu plus délicat.
En effet, avec certaines espèces chimiques, telles que l'ion permanganate et le manganèse, on ne peut pas passer de l'un à l'autre par un simple transfert d'électrons.
Des molécules d'eau et des protons () apparaissent dans la demi-équation.
Prenons l'exemple de l'ion permanganate et du manganèse dont le couple est .
Étape 1 : on commence à écrire ceci :
On vérifie si l'élément chimique est équilibré (ici oui, un de chaque côté)
Étape 2 : on a oxygène à gauche, il en faut aussi à droite.
Pour cela, on rajoutera donc molécules d'eau, chaque molécule apportant un oxygène :
Étape 3 : il y a 8 atomes d'hydrogène à droite (par l'ajout des molécules d'eau), on équilibre donc à gauche en rajoutant des protons (ou ions oxonium ) :
Étape 4 : pour finir, on équilibre le nombre de charges, 7+ à gauche et 2+ à droite, en rajoutant donc 5 électrons à gauche :
V. Oxydant réduit et réducteur oxydé
Définitions :
Durant la réaction d'oxydo-réduction :
L'oxydant est réduit, il gagne des électrons : (= réduction)
Le réducteur est oxydé, il perd des électrons : (= oxydation).
= Merci à Skops pour avoir contribué à l'élaboration de cette fiche =