I. Principe de la spectrophotométrie
1. Absorbance et spectre d'absorption
La lumière blanche, qui traverse une solution colorée (par exemple à base de permanganate de potassium, conférant une couleur violette à la solution), voit certaines de ses radiations lumineuses absorbées par cette solution.
Définitions :
L'absorbance d'une solution, grandeur notée et sans unité, correspond à la quantité de lumière absorbée par cette solution, à une certaine longueur d'onde.
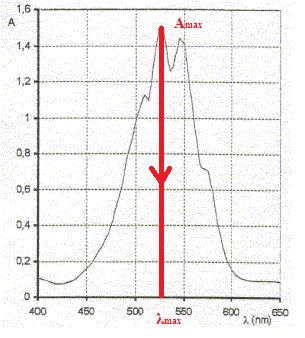
La mesure de l'absorbance d'une même solution à différentes longueurs d'onde nous permet d'obtenir une courbe : on obtient ce qu'on appelle le spectre d'absorption de la solution colorée.
Par le biais de ce spectre, on cherche à déterminer la valeur de la longueur d'onde pour laquelle l'absorbance de la solution sera maximale (= maximum de la courbe ). A , la valeur de l'absorbance étant maximale, l'incertitude sur la mesure de sera minimale : la mesure effectuée sera donc plus précise.
Spectre d'absorption d'une solution de permanganate de potassium
2. Mesure de l'absorbance : le spectrophotomètre
Pour mesurer l'absorbance, on utilise un appareil appelé spectrophotomètre.
Son utilisation est simple :
Avant toute mesure, l'appareil doit être étalonné : on règle la valeur de l'absorbance nulle grâce à une petite cuve remplie d'eau distillée ;
On place ensuite dans cet appareil une cuve remplie de la solution pour laquelle on souhaite déterminer la valeur de l'absorbance.
II. Loi de Beer-Lambert
1. Facteurs influençant l'absorbance
Les facteurs qui influencent l'absorbance d'une solution colorée sont les suivants :
La longueur d'onde de la lumière qui la traverse ;
Sa nature, c'est-à-dire des espèces chimiques absorbantes la constituant ;
Sa concentration ;
Sa température.
2. Énoncé de la loi
Loi de Beer-Lambert :
L'absorbance d'une solution colorée est liée à sa concentration en quantité de matière (ou molaire) par la relation :
avec :
l'absorbance de la solution (sans unité),
concentration en quantité de matière (ou molaire) de l'espèce colorée en solution (),
l'épaisseur de solution traversée (),
coefficient d'extinction molaire (), qui dépend de l'espèce chimique absorbante, de et de la température.
Remarques :
L'absorbance d'une solution colorée (facilement mesurable à l'aide du spectrophotomètre) et sa concentration en quantité de matière (ou molaire) sont donc proportionnelles.
En effet, la largeur de la cuve utilisée dans le spectrophotomètre étant constante, la loi de Beer-Lambert peut s'exprimer encore plus simplement :
avec () en
: la proportionnalité entre et n'est valable que pour les solutions diluées ().
III. Application : dosage par étalonnage
1. Rappels sur le dosage par étalonnage
Le principe du dosage par étalonnage est expliqué dans la fiche suivante (§IV) :
Les solutions aqueuses : dissolution, dilution et dosage par étalonnage
Remarque importante : le principe de dilutions successives (sur la base d'une solution mère) de concentrations en masse (ou massique) connues s'applique également pour les concentrations en quantité de matière (ou molaire). En effet, dans les deux cas, l'ajout d'eau ne modifie pas la quantité de matière de l'espèce présente en solution.
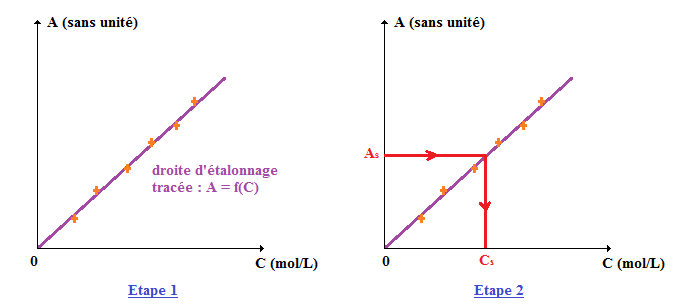
2. Droite d'étalonnage
Connaissant les concentrations en quantité de matière (ou molaires) des différentes solutions étalons (obtenues par dilutions successives d'une solution mère), on peut déterminer leurs absorbances respectives à l'aide du spectrophotomètre.
Dans un repère, on peut placer les points .
On trace alors la droite reliant l'ensemble de ces points : c'est ce qu'on appelle la droite d'étalonnage .
Ainsi, pour une solution de concentration en quantité de matière inconnue , en ayant mesuré son absorbance au préalable, on peut la déduire par le biais de la droite d'étalonnage :