Au début des années 1920, Gilbert Newton Lewis (1875-1946) propose un modèle pour décrire une molécule faisant intervenir tous les électrons de valence des atomes liés entre eux par des liaisons de covalence.
I Modèle de Lewis d’une molécule
• Un doublet liant ou liaison covalente entre deux atomes d’une molécule est la mise en commun de deux électrons. Le doublet liant permet à chaque atome impliqué de gagner un électron sur sa couche externe. Il est symbolisé par un tiret.
• Un doublet non liant est une paire d’électrons de la couche externe d’un atome qui n’est pas impliqué dans une liaison de covalence.
Chaque atome d’une molécule s’entoure du nombre suffisant d’électrons pour acquérir une configuration électronique stable, en saturant sa couche de valence. L’atome acquiert ainsi la configuration du gaz rare voisin en 1s2 ou ns2np6. Cette règle fixe le nombre de liaisons que peuvent former les atomes.
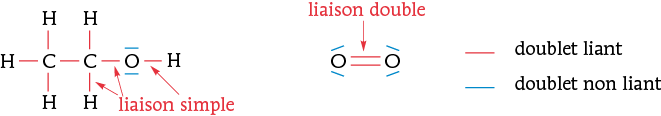
Exemples :
Repère
À noterÀ l’exception de l’hydrogène, tous les atomes d’une molécule sont entourés de quatre doublets dont au moins un liant.
• L’hydrogène H (Z = 1 ; 1s1) se lie une fois ; il est dit monovalent.
• L’oxygène O (Z = 8 ; 1s2 2s2 2p4) se lie 2 fois pour acquérir la configuration en octet : 2s2 2p6. L’oxygène est dit divalent : il forme 2 liaisons de covalence (2 doublets liants) et possède 2 doublets non liants.
Exemples : Formules de Lewis de l'éthanol et du dioxygène.
II Énergie de liaison
Pour rompre une liaison covalente entre deux atomes, il est nécessaire de fournir de l’énergie : c’est un processus endothermique. À l’inverse, la formation d’une liaison covalente est un processus exothermique.
Plus la liaison à casser est forte, plus la quantité d’énergie qu’il faudra apporter est importante. Au cours d’une transformation chimique, des liaisons sont rompues et d’autres sont formées.
Méthode1 Déterminer le nombre de liaisons engendrées par un atome
On considère les atomes de carbone (Z = 6) et d’azote (Z = 7). Déterminer leur valence (le nombre de liaisons qu’ils formeront au sein d’une molécule).
Repère
ConseilsÉcrivez la configuration électronique de l’atome à partir de son numéro atomique Z, puis déduisez-en le nombre d’électrons de sa couche externe. Déterminez enfin le nombre d’électrons qu’il doit acquérir pour satisfaire à la règle de stabilité (de l’octet ou du duet). Ce nombre correspond au nombre de liaisons qu’il engendrera.
SolutionLe carbone C a pour numéro atomique Z = 6. Sa configuration électronique est : 1s2 2s2 2p2 ; il se lie 4 fois car il lui manque 4 électrons pour obtenir la saturation de sa couche externe, soit une configuration en octet : 2s2 2p6.
Le carbone engendrera toujours 4 liaisons de covalence : on dit que le carbone est tétravalent. Il va partager 4 doublets liants.
L’azote N a pour numéro atomique Z = 7 ; sa configuration électronique est 1s2 2s2 2p3 ; il se lie 3 fois car il lui manque 3 électrons pour acquérir la configuration externe en octet : 2s2 2p6. Il va partager 3 doublets liants et possède un doublet non liant.
2 Exploiter le schéma de Lewis d’une molécule
a. Que représentent ci-contre un tiret noir et un tiret bleu ?
b. Combien de liaisons engendrent les atomes d’oxygène et d’hydrogène ?
ConseilSb. Comptez les liaisons qu'engendre un atome. Suivant leur nombre, il peut former des liaisons simple, double ou triple.
Solutiona. Un tiret noir représente un doublet liant ou liaison entre deux atomes d’une molécule, c’est la mise en commun de deux électrons de leur couche externe. Le tiret bleu est un doublet d’électrons non liant de la couche externe propre à un seul atome.
b. L’atome d’oxygène engendre soit deux liaisons simples ou une double liaison, il est divalent. L’hydrogène n’engendre qu’une seule liaison, il est monovalent.