Légende de la leçon
Vert : définitions
I. La structure et la stéréochimie des acides aminés
Un acide α-aminé est un composé organique portant, sur un même atome de carbone, une fonction amine primaire —NH2 et un groupe acide carboxylique —COOH. La lettre α (« alpha ») signifie que le groupe NH2 est porté sur le carbone adjacent à COOH.
Dans le nom acide aminé, on retrouve donc la fonction acide carboxylique et la fonction amine.
L’atome de carbone porteur de ces deux fonctions est aussi lié à un atome d’hydrogène et à une chaîne latérale R, qui peut être une chaîne hydrocarbonée simple ou porteuse de groupes fonctionnels.
1) Quelques groupes caractéristiques
On connaît environ 150 acides aminés dans les organismes vivants, dont la plupart sont des acides α-aminés. Vingt acides α-aminés seulement participent à la synthèse des protéines, dont huit sont appelés acides α-aminés essentiels car ils ne sont pas synthétisés par le corps humain et doivent être apportés par les aliments sous forme de protéines.

On reconnaît divers groupes fonctionnels sur les chaînes R :
- OH : hydroxyle ou fonction alcool (thréonine et sérine) ;
- SH : thiol (cystéine).
On trouve dans d’autres acides aminés non représentés des groupes —NH2 : amine (arginine, lysine, etc.), —COOH : carboxyle (acide glutamique, acide aspartique, etc.).
2) Le carbone asymétrique C*
Un carbone est asymétrique s’il comporte 4 atomes ou groupes d’atomes différents. On le met en évidence en le marquant d’un petit astérisque : C*.
Tous les acides aminés, sauf le plus simple, la glycine, ont au moins un carbone asymétrique dans leur formule.
Exemples
Le carbone pointé de l’alanine porte : 1 H, 1 COOH, 1 CH3 et 1 NH2. Ces 4 groupes d’atomes sont différents donc ce carbone est asymétrique.
Il n’y a pas de carbone asymétrique dans la glycine car le carbone porteur de NH2 et de COOH est lié à deux H. Il n’y a donc pas 4 groupes d’atomes différents.
3) La chiralité et l’énantiomérie
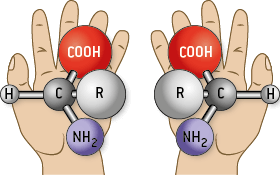
Nos deux mains ne peuvent pas se superposer l’une sur l’autre. En revanche, elles sont symétriques l’une de l’autre par rapport à un plan ou dans un miroir plan. Nos deux mains sont chirales.
Une molécule A est chirale si son symétrique B par rapport à un plan ne lui est pas identique. Les deux molécules A et B ne sont pas superposables : on dit qu’A et B sont énantiomères ou bien qu’il y a une relation d’énantiomérie entre les deux.
Remarque
Une molécule comportant un carbone asymétrique peut exister sous deux formes différentes dans l’espace : ce sont deux énantiomères.
4) Les représentations
a) La représentation de Cram
Il est possible de représenter en perspective un environnement autour d’un atome de carbone à l’aide des règles suivantes :
- les liaisons dans le plan utilisent des traits fins :
- les liaisons en arrière du plan sont en pointillé :
- les liaisons en avant du plan sont un triangle plein :
Exemple
Représentation des 2 énantiomères de l’alanine avec la méthode de Cram :
Ces 2 molécules ne sont pas superposables mais elles sont symétriques l’une de l’autre dans un miroir plan. Ces 2 molécules différentes ont la même formule semi-développée, elles sont chirales.
b) La représentation de Fisher
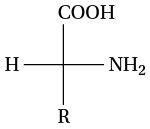
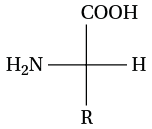
Il s’agit d’une représentation adaptée aux acides α-aminés et aux glucides. On représente un atome central (en général un carbone asymétrique porteur du groupe amine et du groupe carboxyle) et ses quatre substituants sous forme d’une croix : le carbone central est placé au point d’intersection.
- le groupe COOH est placé en haut ;
- le groupe R est placé en bas ;
- l’atome H et le groupe NH2 sont placés sur les deux traits horizontaux.
Les deux traits verticaux représentent des liaisons placées en arrière du carbone central considéré dans le plan de la feuille, alors que les deux traits horizontaux représentent les liaisons placées en avant du carbone central. La représentation de Cram équivalente est donnée dans la figure ci-contre.
Configuration D ou L d’un acide α−aminé
Tous les acides α-aminés, sauf la glycine, comportent un carbone asymétrique au niveau du groupement α-aminé et ont donc au moins deux énantiomères. La projection de Fisher de ces énantiomères ne diffère que par le placement horizontal de l’atome H et du groupe NH2 puisque les groupes COOH et R sont placés sur les positions verticales.
Lorsque le groupe NH2 est situé à droite dans la représentation de Fisher, il s’agit alors d’un énantiomère ayant une configuration D. Inversement, si le groupe NH2 est situé à gauche, il s’agit alors d’un énantiomère ayant une configuration L.
Exemple
Dans le cas de l’alanine, l’alanine a donc deux énantiomères : l’alanine de configuration D et celle de configuration L.
Dans la nature, tous les acides α-aminés constituant les protéines sont de configuration L. Ils ont donc tous cette représentation :
Seul le groupe R change d’un acide aminé à un autre, mais la configuration L reste la même.
II. Les peptides et les liaisons peptidiques
1) La réaction entre deux acides aminés : la liaison peptidique
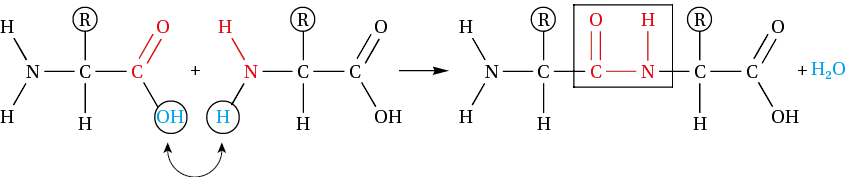
La fonction acide carboxylique d’un acide aminé peut réagir avec la fonction amine d’un autre acide aminé pour former une fonction amide. Cette liaison unissant deux acides aminés s’appelle liaison peptidique.
La liaison peptidique en rouge dans le produit est un cas particulier du groupe amide. Cette réaction permettant l’union de molécules avec élimination d’eau est une condensation : c’est la réaction inverse de l’hydrolyse.
Lorsque deux acides aminés différents réagissent ensemble, il peut se former 4 dipeptides puisque chaque acide aminé a deux groupes fonctionnels. Ainsi, la réaction entre les acides aminés glycine (Gly) 

2) Retrouver les acides aminés constituant un peptide
Un dipeptide est l’union de 2 acides α-aminés, un tripeptide est l’union de 3 et un polypeptide est l’union d’un plus grand nombre. On retrouve les acides α-aminés constitutifs en étudiant la chaîne du polypeptide (la liaison peptidique est encadrée) :
Ce dipeptide comporte dans l’ordre l’alanine Ala :
et la cystéine Cys :
Le dipeptide est donc Ala-Cys.
III. Structure tridimensionnelle et action
La structure des protéines a quatre niveaux d’organisation :
- la structure primaire correspond à la séquence en acides aminés : Ala-Gly-Ser etc.
- la structure secondaire décrit l’arrangement de blocs d’acides aminés selon des formes particulières stabilisées par des liaisons hydrogène : hélices, feuillets, tonneaux, coudes. Il peut y avoir plusieurs types de structures secondaires ;
- la structure tertiaire est la forme générale de la protéine, observable à l’échelle de la molécule tout entière, liée aux interactions entre les différents éléments de la structure secondaire. Il y a souvent repliement de la protéine ;
- la structure quaternaire est l’assemblage complexe de plusieurs protéines.
Les protéines ne sont pas des molécules entièrement rigides : elles peuvent adopter plusieurs conformations afin de réaliser leurs fonctions biologiques.
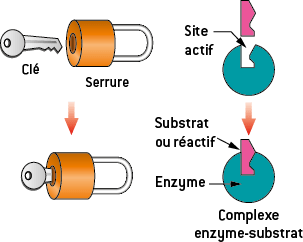
Les enzymes sont des catalyseurs, elles sont constituées de protéines. Elles orientent les réactions biochimiques dans le corps en prenant des conformations particulières. Une réaction ne peut se faire qu’avec les réactifs ayant la bonne configuration. C’est le principe de la serrure et de la clé : la porte s’ouvre avec la bonne clé. Ici, la réaction se fait avec les bons réactifs pour donner les produits souhaités.