I. Masse volumique
Définition :
La masse volumique d'un corps de masse et de volume est :
Unités : est en ; est en ; est en .
II. Densité
Définition :
La densité d'un corps est le rapport entre la masse volumique de ce corps et la masse volumique du corps de comparaison pris dans les mêmes conditions :
Le corps de comparaison est :
L'eau pour les solides et les liquides ;
L'air pour les gaz.
Unités : est en ; est en ; est sans unité.
III. Loi des gaz parfaits
Énoncé :
Si la température et la pression ne sont pas trop élevées, un gaz peut être considéré comme parfait. Sa quantité de matière , sa pression , sa température et son volume sont liés par la relation :
si est la constante des gaz parfaits.
Unités : est en ; est en ; est en (kelvin) ; alors ().
Remarque : dans les mêmes conditions, le volume molaire est le même pour tous les gaz.
Exemples :
Dans les conditions normales ( ; d'où , ), .
Dans les conditions habituelles (, ), .
IV. Concentration en quantité de matière d'une solution
Définition :
Si on dissout mol de soluté dans l'eau pour faire un volume de solution, alors la concentration en quantité de matière (ou molaire) de la solution est :
Unités :
Usuelles : est en ; est en ; est en ;
S.I : est en ; est en ; est en .
V. Concentration en quantité de matière d'une espèce présente en solution
Définition :
Si le volume d'une solution contient mol de l'espèce , alors la concentration en quantité de matière (ou molaire) de dans cette solution est :
Unités :
Usuelles : est en ; est en ; est en ;
S.I : est en ; est en ; est en .
VI. Concentration en masse d'une espèce présente en solution
Définition :
Si le volume d'une solution contient la masse de l'espèce , alors la concentration en masse (ou titre massique) de dans cette solution est :
Unités :
Usuelles : est en ; est en ; est en .
S.I : est en ; est en ; est en .
Remarque :
,
mais par définition
donc ,
mais ,
donc :
VII. Concentration en masse d'une solution
Définition :
Si on dissout une masse de soluté dans l'eau pour faire un volume de solution, alors la concentration en masse (ou titre massique) de cette solution est :
Unités :
Usuelles : est en ; est en ; est en ;
S.I : est en ; est en ; est en .
Remarque : on a aussi .
VIII. Conductance d'une solution ionique diluée
Définition :
La conductance d'une portion de solution est l'inverse de la résistance .
Propriété :
La conductance de la portion de solution ionique entre les électrodes et est :
Unités : est en ; est en ; est en siemens ().
Remarque : l'expression de la loi d'Ohm pour la portion de solution entre les électrodes et est ou .
Expression :
La conductance de la portion d'une solution ionique entre deux électrodes parallèles, de surface et distantes de , est :
si est la conductivité de la solution.
Unités : est en ; est en ; est en ; est en .
IX. Conductivité d'une solution ionique diluée
Définition :
La conductivité d'une solution dépend de la nature des ions présents dans cette solution et de leur concentration molaire :
si est la conductivité molaire ionique de l'ion .
Unités : est en S.m⁻¹ ; est en mol.m⁻³ ; est en S.m².mol⁻¹.
X. Dosage ou titrage
Définitions :
Titrer ou doser une espèce chimique dans une solution : c'est déterminer sa concentration molaire dans cette solution.
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stœchiométriques.
À l'équivalence, le réactif titrant et le réactif titré ont entièrement réagi.
Exemples :
Dosage conductimétrique (de l'ion par l'ion ) ;
Dosage colorimétrique à l'aide d'un indicateur coloré ;
Dosage pH-métrique à l'aide d'une sonde à ;
Dosage potentiométrique (hors programme).
XI. Réaction chimique et avancement
Définition :
L'avancement de la réaction, noté , exprimé en mol, permet de suivre l'évolution des quantités de matières des réactifs et des produits au cours de la transformation chimique.
Propriété :
Pour une équation chimique du type , si l'avancement de la réaction est , c'est que les quantités de réactif et de réactif ont été consommées. Simultanément, les quantités du produit et du produit ont été formées.
Tableau descriptif du système chimique en évolution :
un état initial (à ) : l'avancement de la réaction est nul.
un état intermédiaire (à ) : l'avancement de la réaction est .
un état final (à ) : l'avancement de la réaction est .
Attention : l'état maximal () n'est pas systématiquement atteint ! C'est un état théorique qui permet de déterminer le ou les réactif(s) limitant(s).
XII. Réactions d'oxydoréduction
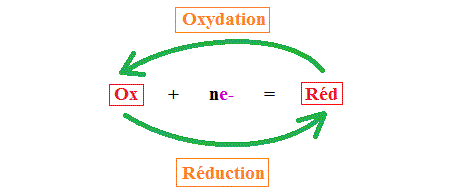
Définitions :
Un oxydant est une espèce chimique capable de capter , ou électrons ().
Un réducteur est une espèce chimique capable de céder , ou .
Une oxydation est une perte de .
Une réduction est un gain de .
Un couple oxydant/réducteur, noté , est constitué de deux espèces chimiques conjuguées qui échangent des selon la demi-équation électronique :
Une réaction d'oxydoréduction est un transfert de du réducteur d'un couple vers l'oxydant d'un autre couple.
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =