I. Solubilité d'un solide ionique ou moléculaire
1. Notion de solubilité
Définition :
La solubilité est la capacité maximale d'une substance, appelée soluté, à se dissoudre dans une autre substance, appelée solvant, pour former un mélange homogène appelé solution ;
Lorsque la limite maximale est atteinte, la solution est dite saturée.
Exemple : la solubilité du chlorure de sodium dans l'eau est ().
2. Propriétés
Propriétés associées à la solubilité :
La solubilité d'un solide (moléculaire ou ionique) dans un solvant est fonction des interactions électrostatiques établies entre les entités constituant ce solide et les molécules du solvant.
Les solides ioniques et les solutés moléculaires polaires sont solubles dans les solvants polaires et les solutés apolaires sont solubles dans les solvants apolaires.
La température peut également influencer la solubilité d'un solide.
Remarque : la molécule d'eau est polaire. L'eau est donc un très bon solvant pour les solides ioniques.
II. Dissolution des solides ioniques
1. Processus de dissolution d'un solide ionique dans l'eau
Propriété :
La dissolution d'un solide ionique dans l'eau se déroule en 3 étapes :
La dissociation : les molécules d'eau affaiblissent les interactions entre les ions du cristal ionique qui se désagrège ;
La solvatation : les ions s'entourent de molécules d'eau. Quand un ion est hydraté, on lui rajoute (aq) à la fin de la formule ;
La dispersion : les ions hydratés se dispersent dans la solution qui devient homogène grâce à une agitation thermique et mécanique.
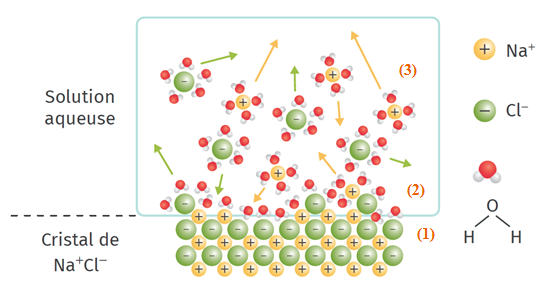
Remarques :
Lors de la solvatation, les interactions électrostatiques qui lient les ions entre eux ne sont plus en mesure d'assurer la cohésion du solide : les interactions des ions avec les molécules polaires du solvant sont devenues prédominantes.
Les molécules du solvant polaire entourant le composé ionique s'orientent de manière à produire une interaction toujours attractive avec les ions qui sont dissous.
2. Equation-bilan d'une dissolution
La dissolution d'un solide ionique dans l'eau peut s'écrire par le biais d'une équation-bilan, appelée parfois équation de dissociation.
Pour un solide ionique de formule générale constitué des ions et , cette équation s'écrit :
En vertu du principe de Lavoisier, la dissolution étant une transformation (ou réaction) chimique, elle est caractérisée par une conservation de la matière. Elle se traduit de deux manières :
Conservation de la masse totale du système (autrement dit, conservation du nombre d'atomes des éléments chimiques constituant le système) ;
Conservation de la charge globale du système.
3. Concentrations en quantité de matière (ou molaires) issues d'une dissolution
La concentration en quantité de matière (ou concentration molaire) en soluté apporté est généralement notée voire .
Les concentrations en quantité de matière des ions dans la solution aqueuse sont notées et .
Elles ont pour expressions :
et
Les concentrations molaires sont exprimées en ou .
Attention : pour exprimer la concentration molaire des ions dissous en fonction de la concentration molaire en soluté apporté, il conviendra de tenir compte des coefficients stœchiométriques de l'équation-bilan de la dissolution.
III. Dilution
La dilution a été abordée en détail en classe de seconde dans la fiche suivante :
Les solutions aqueuses : dissolution, dilution et dosage par étalonnage
La relation établie pour la concentration en masse est également valable pour la concentration en quantité de matière (molaire) : l'ajout d'eau ne modifie pas la quantité de matière du soluté dissout dans l'eau.
IV. Application : mélange de deux solutions ioniques
1. Énoncé du problème
Partie 1. Préparation d'une solution de chlorure de cuivre (II)
On souhaite préparer une solution de chlorure de cuivre (II) de concentration molaire en soluté apporté et de volume .
a. Quelle masse de chlorure de cuivre (II) faut-il prélever pour préparer cette solution ?
b. Sachant que la formule statistique du chlorure de cuivre (II) est , écrire l'équation de dissolution de l'espèce chimique dans la solution.
c. Déterminer les concentrations molaires en ions cuivre (II) et ions chlorure présents dans la solution.
Partie 2. Préparation d'une solution de chlorure de fer (III)
On souhaite désormais préparer une solution de chlorure de fer (III) de concentration molaire en soluté apporté et de volume .
a. Quelle masse de chlorure de fer (III) faut-il prélever pour préparer cette solution ?
b. Sachant que la formule statistique du chlorure de fer (III) est , écrire l'équation de dissolution de l'espèce chimique dans la solution.
c. Déterminer les concentrations molaires en ions fer (III) et ions chlorure présents dans la solution.
Partie 3. Mélange des solutions et
On souhaite enfin préparer une solution en mélangeant les solutions et initialement préparées.
a. Quel est le volume de la solution ?
b. Quelles sont les concentrations molaires en ions cuivre (II), fer (III) et chlorure présents dans cette nouvelle solution ?
2. Solution
Partie 1. Préparation d'une solution de chlorure de cuivre (II)
a. Soit la masse de chlorure de cuivre (II) à dissoudre.
Par définition, la concentration molaire en soluté apporté est si est la quantité de matière dissoute.
Or, la quantité de matière peut s'exprimer de la façon suivante : si est la masse molaire de cette espèce.
Finalement, on a
.
Application numérique :
Soit
Remarque : un bon entraînement consisterait à rappeler le protocole expérimental de préparation d'une telle solution !
b. L'équation de dissolution du chlorure de cuivre (II) dans l'eau est
c. D'après l'équation de dissolution, pour mole de dissoute, il se forme mole de et moles de .
On peut donc écrire
Or, par définition de la concentration molaire :
En simplifiant la relation par , on obtient finalement :
Application numérique : .
Partie 2. Préparation d'une solution de chlorure de fer (III)
a. Soit la masse de chlorure de fer (III) à dissoudre.
Par définition, la concentration molaire en soluté apporté est si est la quantité de matière dissoute.
Or, la quantité de matière peut s'exprimer de la façon suivante : si est la masse molaire de cette espèce.
Finalement, on a
Application numérique :
Soit
Remarque : un bon entraînement consisterait à rappeler le protocole expérimental de préparation d'une telle solution !
b. L'équation de dissolution du chlorure de fer (III) dans l'eau est
c. D'après l'équation de dissolution, pour mole de dissoute, il se forme mole de et moles de .
On peut donc écrire
Or, par définition de la concentration molaire :
En simplifiant la relation par , on obtient finalement :
Application numérique : .
Partie 3. Mélange des solutions et
a. Le volume de la solution correspond à la somme des solutions et , soit :
b. En l'absence de transformation chimique, les quantités de matières des ions cuivre (II), fer (III) et chlorure se conservent.
Immédiatement, on obtient :
et
Concernant l'ion chlorure, il faut sommer les quantités de matières des solutions :
Application numérique :
.
= Merci à gbm / Skops pour avoir contribué à l'élaboration de cette fiche =
