I. Modèle ondulatoire et particulaire de la lumière : rappels
1. Modèle ondulatoire de la lumière
Le modèle ondulatoire de la lumière, déjà introduit en classe de 1re, a été revu dans la fiche suivante :
Les ondes lumineuses : des ondes électromagnétiques
2. Modèle particulaire de la lumière
Le modèle particulaire de la lumière, essentiel pour appréhender l'effet photoélectrique, a été abordé en classe de 1re. Il est donc primordial de réviser la fiche suivante (§III) :
Parmi les notions à réviser :
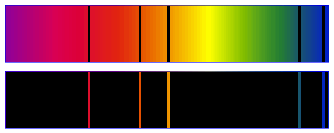
Les spectres atomiques : d'une lumière, de raies, d'émission et d'absorption ;
Les atomes excités émettent un rayonnement pour certaines fréquences seulement (ces atomes se désexcitent en émettant de l'énergie lumineuse).
Les fréquences des couleurs absorbées par un atome sont les mêmes que celles qui sont émises par ce même atome quand il est excité.
Exemple de spectres d'absorption et d'émission (pour le mercure) :
Pour expliquer le "caractère discret" des fréquences émises ou absorbées par un atome (c'est-à-dire quand l'atome ne peut émettre ou absorber que certaines couleurs), des postulats ont été émis concernant l'échange d'énergie entre l'atome et la lumière.
En 1900, Max Planck a postulé : "l'énergie transportée par les ondes électromagnétiques émises ou absorbées par un atome est quantifiée, c'est-à-dire qu'elle ne peut s'échanger que par paquets ou quanta d'énergie".
En 1905, Albert Einstein a postulé : "ces quanta d'énergie sont portés par des particules appelées photons".
Pour une onde électromagnétique de fréquence , de longueur d'onde et de célérité dans le vide, l'énergie d'un photon est :
où est la constante de Planck et la célérité de la lumière dans le vide .
Le photon est un corpuscule de masse nulle, de charge nulle, qui se propage à la célérité de la lumière dans le vide ou l'air.
Unités S.I. : est en ; est en ; est en ; est en m.s ; est en .
En 1913, Niels Bohr énonce deux postulats :
1er postulat : l'énergie d'un atome est quantifiée.
L'énergie d'un atome ne peut prendre que certaines valeurs bien déterminées. On dit que l'atome ne peut exister que dans dans un nombre discret de niveaux d'énergie.
Chaque niveau d'énergie de l'atome correspond à un état de l'atome, c'est-à-dire à une répartition des électrons autour du noyau :
L'état fondamental de l'atome est l'état de plus basse énergie (pour lequel les électrons sont le plus liés au noyau) ;
Un état excité de l'atome est un état de l'atome qui a absorbé de l'énergie, donc pour lequel les électrons sont moins liés au noyau que dans l'état fondamental ;
L'état ionisé de l'atome est l'état pour lequel l'atome a perdu un électron.
2e postulat : les variations d'énergie d'un atome sont quantifiées.
Le passage d'un niveau d'énergie à un autre, appelé transition, s'accompagne de l'émission ou de l'absorption d'un photon.
L'énergie du photon émis ou absorbé (constante de Planck x fréquence) est égale à la variation de l'énergie de l'atome :
Représentation avec un diagramme d'énergie :
 II. Effet photoélectrique
II. Effet photoélectrique
1. Définition
Dans le § précédent, il a été rappelé que l'atome ne peut exister que dans dans un nombre discret de niveaux d'énergie, chaque niveau d'énergie de l'atome correspond à un état de l'atome, c'est-à-dire à une répartition des électrons autour du noyau : l'état fondamental, l'état excité et l'état ionisé.
L'effet photoélectrique est un phénomène physique dans lequel des électrons sont émis par un matériau, généralement un métal, lorsqu'il est exposé à la lumière ou à un autre rayonnement électromagnétique d'une certaine fréquence.
C'est en 1839 qu'est découvert l’effet photoélectrique par le physicien français Antoine Becquerel (le grand-père du découvreur de la radioactivité).
2. Analyse qualitative de l’effet photoélectrique
Lorsqu'un rayonnement électromagnétique (correspondant à un flux de photons) frappe la surface d'un matériau, elle peut transférer son énergie aux électrons de ce dernier. Si l'énergie de la lumière est suffisante, elle peut arracher des électrons de sa surface.
Propriété :
Il existe une fréquence minimale du rayonnement, appelée fréquence de seuil, en dessous de laquelle aucun électron n'est émis, peu importe l'intensité de ce rayonnement. Cela montre que l'effet photoélectrique dépend de la fréquence de la lumière et non de son intensité.
Ainsi, l'énergie cinétique des électrons émis dépend de la fréquence du rayonnement incident et non de son intensité. Un rayonnement de fréquence plus élevée libère des électrons avec une énergie cinétique plus élevée.
3. Relation entre l’énergie cinétique des électrons et la fréquence
Le travail d'extraction, également appelé travail de sortie, est l'énergie minimale nécessaire pour extraire un électron de la surface d'un matériau, généralement un métal, et le libérer dans le vide :
où (parfois noté ) est le travail d'extraction (en ), la constante de Planck et la fréquence de seuil (en ).
Cette énergie est spécifique à chaque matériau et dépend de la structure électronique du matériau, ainsi que de sa surface.
Remarques : le travail d'extraction peut également être exprimé en électron-volt :
Dans l'équation de l'effet photoélectrique d'Einstein :
si :
est l'énergie du photon incident (en voire en ) ;
est le travail d'extraction (même unité) ;
est l'énergie cinétique cinétique de l'électron arraché, correspondant à l'énergie excédentaire emportée par ce dernier (même unité) ;
est la masse de l'électron arraché () ;
est la vitesse maximale de l'électron arraché (en ).
Remarques :
L'énergie du photon incident doit être suffisante pour arracher un électron du matériau (proche de sa surface) ;
Si l'énergie du photon incident est inférieure au travail d'extraction, aucun électron ne sera émis, même si l'intensité de la lumière est augmentée.
III. Applications industrielles de l'effet photoélectrique
Les applications industrielles actuelles mettant en jeu l’interaction photon-matière sont les suivantes :
Les capteurs de lumière : ils sont utilisés dans les appareils photo et les systèmes de sécurité ;
Les cellules photovoltaïques : elles sont utilisées pour faire de la conversion de l'énergie solaire en électricité ;
Les lampes à diodes électroluminescentes (LED) : elles sont utilisées pour un éclairage efficace et durable, en remplacement des ampoules à incandescence (à filament ou halogènes) ou bien fluo-compacte, plus consommatrices en électricité ;
Spectroscopies UV-visible et IR : elles sont des techniques analytiques pour identifier les substances chimiques.
IV. La cellule photovoltaïque : enjeux énergétiques et fonctionnement
1. Enjeux énergétiques : contexte général
Ce contexte général n'est pas à connaître par cœur ! Il permet simplement d'appréhender un sujet majeur pour l'humanité.
L'économie du monde actuel repose principalement sur l'utilisation d'énergies fossiles, à savoir : le pétrole, le charbon et le gaz naturel.
La consommation d'énergie fossile se répartit majoritairement dans les secteurs du transport, de l'industrie, de l'électricité et du bâtiment (chauffage des bâtiments résidentiels et tertiaires).
Le pétrole est utilisé à plus de 60% dans le domaine des transports pour faire avancer des voitures et des camions (transport terrestre), mais aussi des bateaux (transport maritime) et des avions (transport aérien). Chacun de ces modes de transport utilise presque exclusivement le pétrole comme énergie. Le reste du pétrole est surtout utilisé en pétrochimie pour produire des objets contenant du plastique, matériau omniprésent aujourd'hui.
Le charbon est utilisé à plus de 67% pour produire de l'électricité, principalement via des centrales électriques à charbon. Le reste du charbon est utilisé pour produire de l'acier (car c'est un alliage de fer et de carbone) et du ciment.
Le gaz naturel est quant à lui utilisé dans environ 25% de la production d'électricité mondiale. Le reste du gaz naturel est surtout utilisé pour le chauffage des bâtiments résidentiels et tertiaires et dans les fours et chaudières industriels.
Toutes ces énergies sont utilisées en les brûlant, c'est-à-dire via une réaction de combustion. Les produits de ces combustions, comme par exemple le dioxyde de carbone (), ont un fort impact sur l'environnement (par exemple le changement climatique) et peuvent être dangereux pour l'Homme.
La consommation massive d'énergies fossiles pose aujourd'hui deux problèmes :
Ces énergies sont disponibles en quantité limitée sur Terre ;
L'utilisation (autrement dit, la combustion) de ces énergies est fortement émettrice de .
Le premier problème montre que le modèle économique actuel basé sur la consommation massive de charbon, pétrole et gaz n'est pas durable. Le second problème va conduire à une augmentation de la température moyenne à la surface du globe de quelques degrés, ce qui va vraisemblablement conduire à des catastrophes climatiques puis humaines largement sous-estimées.
Pour réduire les émissions de dioxyde de carbone et l'utilisation d'énergies fossiles, une piste serait d'avoir recours aux énergies dites renouvelables en tant que substituts, notamment : la géothermie, l'énergie hydraulique, l'énergie solaire et l'énergie éolienne.
La position du nucléaire dans les énergies renouvelables et non renouvelables n'est pas clairement définie, mais cette énergie a l'avantage d'être très peu émettrice de une fois la centrale nucléaire mise en fonctionnement : on peut donc consensuellement parler d'énergie décarbonée.
Cependant, les énergies solaire et éolienne sont des énergies très diffuses (il faut énormément d'éoliennes ou de panneaux solaires pour égaler la puissance d'une centrale nucléaire d'une puissance d'1 GW par exemple) et ne fonctionnent pas en permanence car sont tributaires de l'ensoleillement et du vent. En effet, les installations solaires photovoltaïques ont en moyenne un facteur de charge (= pourcentage du temps sur une année où ces installations fonctionnent effectivement) de 15% et les parcs éoliens français 20%.
Par conséquent, à côté des énergies renouvelables, il est nécessaire de stabiliser la fréquence du réseau (à 50 Hz en France notamment), via une recherche continue d'un équilibre entre la production et la consommation d'électricité :
Soit en ayant des moyens de stockage de cette électricité colossaux, via des batteries (trop onéreuses pour l'heure, sans compter le coût d'adaptation du réseau électrique) ou des STEP (Station de Transfert d’Énergie par Pompage) par exemple ;
Soit en couplant ces énergies à des centrales électriques conventionnelles (charbon, pétrole, gaz ou nucléaire) : cette deuxième option, beaucoup moins onéreuse, devrait privilégier la technologie nucléaire, la seule offrant un moyen décarboné de production d'électricité. C'est le choix fait actuellement par la France pour produire son électricité. Ce mix électrique {renouvelable + nucléaire} est décarboné à plus de 90%.
2. La cellule photovoltaïque : fonctionnement et principe
L’effet photovoltaïque permet la transformation de l’énergie lumineuse en électricité.
Les premières applications ont lieu dès les années 60 avec l’équipement de satellites spatiaux. Puis à partir de 1970, à la suite de la première crise pétrolière, les premières applications sur Terre apparaissent.
Une cellule photovoltaïque, également connue sous le nom de cellule solaire, est un dispositif qui convertit directement la lumière du soleil en électricité grâce à l'effet photovoltaïque.
La plupart des cellules photovoltaïques sont fabriquées à partir de matériaux semi-conducteurs (qui peuvent conduire l'électricité dans certaines condition), le plus souvent du silicium.
Une cellule photovoltaïque typique est composée de deux couches de silicium : une couche dopée avec des atomes qui ont un électron de plus que le silicium (généralement du phosphore), créant une couche de type (négative), et une autre couche dopée avec des atomes qui ont un électron de moins que le silicium (généralement du bore), créant une couche de type (positive). La zone où les couches de type et de type se rencontrent est appelée la jonction .
Lorsque la lumière du soleil frappe la cellule photovoltaïque, elle est absorbée par le matériau semi-conducteur. L'énergie de la lumière (composée de photons) est transférée aux électrons de valence en excès dans la couche , les excitant et les libérant de leurs atomes pour venir combler le déficit d'électrons de la couche . Les photons absorbés créent donc des paires électron - trou (= lacune d'électron). À la jonction , un champ électrique est créé en raison de la diffusion des électrons de la couche vers la couche et des trous (= lacunes d'électrons) de la couche vers la couche .
Le champ électrique à la jonction sépare les électrons et les trous, envoyant les électrons vers la couche et les trous vers la couche . Cela crée une différence de potentiel (tension) entre les deux couches.
Des contacts métalliques sur les couches et permettent de collecter les électrons et les trous. Lorsque la cellule est connectée à un circuit externe, les électrons circulent à travers le circuit, créant un courant électrique continu. Il permet donc de produire de l'électricité utilisable pour alimenter des appareils électriques ou être stockée dans des batteries (pour une utilisation ultérieure).
La puissance par du rayonnement solaire reçu à la surface de la Terre est de l’ordre de , valeur dépendant de la latitude, de la saison et des conditions météorologiques.
La puissance des installations est exprimée en watt-crête (). Le watt-crête est la puissance fournie par un module photovoltaïque pour un ensoleillement normalisé de à une température de .
Le rendement d’une cellule photovoltaïque est le rapport entre la puissance électrique produite par cette cellule et la puissance lumineuse reçue sur sa surface :
la tension délivrée par la cellule (en ) ;
l’intensité du courant délivrée par la cellule (en ) ;
l'énergie lumineuse reçue sur la surface de la cellule (en ) ;
la surface de cette cellule (en ).
Courbe caractéristique d'une cellule photovoltaïque :

Matériau de la cellule : différents matériaux semi-conducteurs ont des rendements différents. Par exemple, les cellules en silicium monocristallin ont généralement un rendement plus élevé que celles en silicium polycristallin.
Les cellules photovoltaïques commerciales ont généralement un rendement compris entre et ;
Les cellules à haut rendement, comme celles utilisées dans les applications spatiales, peuvent atteindre des rendements de plus de ;
Ces faibles rendements sont dus aux pertes (réflexion des rayons incidents, pertes par effet Joule, etc.) et au fait que la sensibilité de la cellule ne couvre pas la totalité du spectre du rayonnement solaire (le seuil de conduction déterminé par une énergie de pour le silicium cristallin, correspondant à une fréquence de , soit un rayonnement infrarouge).
Conditions d'ensoleillement : l'intensité et le spectre de la lumière solaire peuvent affecter le rendement.
Température : les cellules photovoltaïques peuvent voir leur rendement diminuer à des températures élevées.
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =