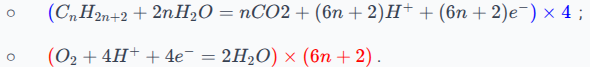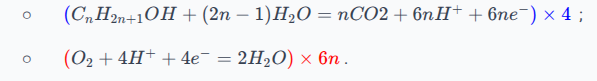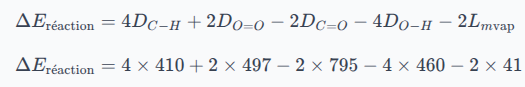I. Combustion des matières organiques
1. Notion de combustion
Définition :
Une combustion est une transformation chimique d'oxydoréduction au cours de laquelle le système libère de l'énergie : c'est une réaction exothermique. Elle s'accompagne donc d'une hausse systématique de température du milieu extérieur.
2. Réactifs et produits d'une combustion
Une combustion se caractérise par le contact de deux réactifs :
Le combustible, qui est l'espèce chimique qui brûle ; c'est celui des réactifs qui a subi une oxydation.
Le comburant, qui est l'espèce chimique qui aide le combustible à brûler (généralement il s'agira du dioxygène ). C'est celui des réactifs qui a subi une réduction.
Propriété :
Lors d'une combustion complète, tout le combustible a réagi (= réaction totale, le dioxygène étant généralement en excès) et les produits formés sont le dioxyde de carbone () et l'eau ().
3. Combustibles organiques usuels
Les combustibles utilisés dans la vie quotidienne sont essentiellement d'origine fossile. Ils résultent de la décomposition d'organismes vivants effectuée pendant plusieurs millions d'années.
Les alcanes et les alcools sont privilégiés comme combustibles car ils ont une forte énergie massique ou volumique :
Le gaz naturel est composé d'hydrocarbures gazeux constitués de méthane (en grande majorité), d'éthane , de propane et de butane . Il est rendu odorant par l'ajout de THT (tétrahydrothiophène) ;
Certaines cheminées ou poêles fonctionnent à l'éthanol .
II. Réaction de combustion des alcanes et des alcools
1. Notion d'alcane et d'alcool
Ces deux notions sont abordées dans les fiches suivantes :
2. Réaction de combustion d'un alcane ou d'un alcool
Comme nous l'avons vu précédemment, la réaction de combustion d'un alcane ou d'un alcool est une réaction d'oxydoréduction entre l'une des deux espèces organiques et le dioxygène, les produits formés étant le dioxyde de carbone et l'eau.
Remarque : pour plus d'information sur une réaction d'oxydoréduction, se référer à la fiche suivante :
Ces réactions exothermiques s'effectuant à des températures élevées, on suppose que cette transformation entre ses réactifs et ses produits se fait à l'état gazeux.
3. Équation-bilan d'une réaction de combustion
Les couples en jeu sont :
;
.
Les demi-équations électroniques, dans le sens de la réaction effective, sont les suivantes :
;
.
On remarque que le nombre d'électrons n'est pas le même, on va donc multiplier la première demi-équation par et la deuxième demi-équation par , on aura donc électrons :
Finalement, l'équation de la réaction (une fois simplifiée) sera :
Les couples en jeu sont :
;
.
Les demi-équations électroniques, dans le sens de la réaction effective, sont les suivantes :
;
.
On remarque que le nombre d'électrons n'est pas le même, on va donc multiplier la première demi-équation par et la deuxième demi-équation par , on aura donc électrons :
Finalement, l'équation de la réaction (une fois simplifiée) sera :
Généralement, il ne sera pas nécessaire de refaire toutes les étapes d'écriture d'une équation-bilan d'oxydoréduction.
En effet, on peut équilibrer ces réactions directement en commençant par équilibrer le carbone et l'oxygène et en terminant par l'hydrogène, selon le principe de Lavoisier. Pour cela, il est conseillé de lire attentivement le §II. 4. de la fiche suivante :
Combustion du propane : (l'équilibrage de cette équation-bilan est détaillé dans la fiche ci-dessus) ;
Combustion de l'éthanol : .
III. Énergie libérée au cours d'une combustion
1. Énergies disponibles dans une molécule
La formation d'une liaison covalente entre deux atomes est une transformation qui conduit à libérer de l'énergie : on dit qu'il s'agit d'un processus exothermique. A l'inverse, la rupture d'une liaison covalente entre deux atomes d'une molécule requiert de l'énergie (dite énergie de liaison) : on dit qu'il s'agit d'un processus endothermique.
Définition :
Pour une liaison covalente entre deux atomes, l'énergie de liaison est égale à l'énergie nécessaire pour rompre une mole de cette liaison entre les deux atomes pris à l'état gazeux : ;
Elle s'exprime en kilojoules par mole ( ou ) ;
Plus la liaison à rompre est forte, plus la quantité d'énergie qu'il faudra fournir est importante. Cette énergie à fournir peut par exemple l'être sous forme thermique.
Propriété :
Au cours d'une transformation chimique, des liaisons covalentes sont rompues et d'autres sont formées.
Définition :
L'énergie molaire de cohésion est égale à l'énergie nécessaire à une mole d'une molécule pour la dissocier en tous ses atomes constitutifs. En d'autres termes, elle est égale à la somme de toutes les énergies de liaison entre les atomes constituant cette molécule.
Ainsi, si on note l'énergie de la liaison covalente entre deux atomes et , on peut écrire :
Elle s'exprime donc également en kilojoules par mole ( ou ).
2. Énergie molaire de la réaction de combustion
Définition :
Au cours d'une combustion, l'énergie molaire de la réaction correspond au bilan des énergies consommées (= liaisons dans le combustible et le comburant - les réactifs - qui se rompent) et libérées (= énergies dans le dioxyde de carbone et l'eau - les produits - qui se forment) ;
Elle correspond donc à la somme algébrique des énergies de liaisons rompues et formées sur la base de l'équation-bilan de la combustion :
Exemple de la combustion du méthane :
L'équation-bilan de la réaction de combustion est :
Si on décompose cette combustion :
Les liaisons du méthane sont rompues ;
La liaison du dioxygène est rompue ;
Les liaisons du dioxyde de carbone sont formées ;
Les liaisons de l'eau sont formées ;
Étant donnée que les énergies de liaisons sont prises à l'état gazeux, il faut tenir compte d'un changement d'état pour l'eau : il s'agit d'une chaleur latente (ou énergie massique de changement d'état) de liquéfaction (= l'inverse de la chaleur latente de vaporisation). En cas de besoin, se référer à la fiche suivante :
En tenant compte des coefficients stœchiométriques, l'énergie molaire de la réaction de combustion du méthane s'écrit :
3. Cas de la combustion des alcanes et des alcools en phase gazeuse
Avec l'exemple traité ci-dessus, on constate que l'énergie molaire d'une réaction de combustion est négative. Cela permet donc de confirmer que de l'énergie est libérée au cours de cette transformation : c'est bel et bien une réaction exothermique.
La totalité de cette énergie cédée à l'extérieur du système chimique l'est sous forme thermique.
Définition :
Connaissant la quantité de matière de combustible introduite dans une réaction de combustion complète (= en supposant que celle-ci sera totale), l'énergie libérée au cours de cette combustion s'écrit :
est l'énergie libérée lors de la combustion (en ) ;
est la quantité de matière du combustible introduite dans la combustion (en ) ;
est l'énergie molaire de la réaction de combustion étudiée (en ).
Définition :
Le pouvoir calorifique d'un alcane ou d'un alcool, noté correspond à l'énergie thermique libérée par une combustion complète de 1 kg de combustible ;
C'est l'opposé de l'énergie libérée au cours d'une réaction de combustion par unité de masse.
C'est donc une grandeur positive, qui s'exprime généralement en ou .
IV. Combustions et enjeux de société
Ce contexte général n'est pas à connaître par cœur ! Il permet simplement d'appréhender un sujet majeur pour l'humanité.
1. Dépendance des sociétés modernes aux énergies fossiles
L'économie du monde actuel repose principalement sur l'utilisation d'énergies fossiles, à savoir :
Le pétrole,
Le charbon
Et le gaz naturel.
La consommation d'énergie fossile se répartit majoritairement dans les secteurs :
Du transport,
De l'industrie,
De l'énergie et de l'électricité,
Et du bâtiment (chauffage des bâtiments résidentiels et tertiaires).
Le pétrole est utilisé à plus de 60% dans le domaine des transports pour faire avancer des voitures et des camions (transport terrestre), mais aussi des bateaux (transport maritime) et des avions (transport aérien). Chacun de ces modes de transport utilise presque exclusivement le pétrole comme énergie. Le reste du pétrole est surtout utilisé en pétrochimie pour produire des objets contenant du plastique, matériau omniprésent aujourd'hui.
Le charbon est utilisé à plus de 67% pour produire de l'électricité, principalement via des centrales électriques à charbon. Le reste du charbon est utilisé pour produire de l'acier (car c'est un alliage de fer et de carbone) et du ciment.
Le gaz naturel est quant à lui utilisé dans environ 25% de la production d'électricité mondiale. Le reste du gaz naturel est surtout utilisé pour le chauffage des bâtiments résidentiels et tertiaires et dans les fours et chaudières industriels.
Toutes ces énergies sont utilisées en les brûlant, c'est-à-dire via une réaction de combustion :
Essence ou gasoil issus du pétrole dans un moteur à combustion (voiture, camion) ;
Charbon dans une centrale électrique (à charbon) ;
Combustion du gaz naturel pour le chauffage domestique.
Les produits de ces combustions, comme par exemple le dioxyde de carbone (), ont un fort impact sur l'environnement (par exemple le réchauffement climatique) et peuvent être dangereux pour l'Homme.
2. Dangers associés aux combustions
Le dioxyde de carbone est un des gaz à effet de serre responsables du réchauffement climatique. Les émissions de ce gaz sont principalement dues à la combustion des énergies fossiles citées plus haut :
Le charbon contribue à environ 40% pour les émissions mondiales de dioxyde de carbone dues aux énergies fossiles ;
Le pétrole y contribue à environ 35%
Et le gaz naturel 21%.
Le dioxyde de carbone n'est pas le seul produit d'une combustion ayant un impact environnemental. Par exemple, lors d'une combustion, les atomes d'oxygène se lient avec les atomes d'azote contenus dans l'air pour former des oxydes d'azote appelés usuellement . Ces gaz sont partiellement responsables des pluies acides. On peut également citer le méthane ou encore l'ozone troposphérique.
A côté de l'impact environnemental, les combustions présentent également des dangers pour les personnes (risque d'incendies, pouvant causer de graves brûlures voire la mort). Un type de combustion, dite incomplète, est particulièrement dangereuse pour les individus. Une combustion est incomplète lorsque le dioxygène est en quantité insuffisante, c'est-à-dire quand il n'y a pas assez d'air. Les combustions incomplètes produisent des suies (particules très fines) et du monoxyde de carbone . Ce dernier est très dangereux pour l'homme car il se fixe très fortement sur l'hémoglobine du sang à la place du dioxygène, empêchant ainsi une oxygénation correcte du corps. De plus, il est inodore et incolore, donc quasiment indétectable par l'Homme. Les oxydes d'azote produits lors de combustions sont également nocifs pour l'Homme.
3. Alternatives aux énergies fossiles
La consommation massive d'énergies fossiles pose aujourd'hui deux problèmes :
Ces énergies sont disponibles en quantité limitée sur Terre ;
L'utilisation (autrement dit, la combustion) de ces énergies est fortement émettrice de .
Le premier problème montre que le modèle économique actuel basé sur la consommation massive de charbon, pétrole et gaz n'est pas durable. Le second problème va conduire à une augmentation de la température moyenne à la surface du globe de quelques degrés, ce qui va vraisemblablement conduire à des catastrophes climatiques puis humaines largement sous-estimées.
Pour réduire les émissions de dioxyde de carbone et l'utilisation d'énergies fossiles, une piste serait d'avoir recours aux énergies dites renouvelables en tant que substituts, notamment :
La géothermie,
L'énergie solaire,
L'énergie éolienne.
La position du nucléaire dans les énergies renouvelables et non renouvelables n'est pas clairement définie, mais cette énergie a l'avantage d'être très peu émettrice de une fois la centrale nucléaire mise en fonctionnement : on peut donc consensuellement parler d'énergie décarbonée.
Cependant, les énergies solaire et éolienne sont des énergies très diffuses (il faut énormément d'éoliennes ou de panneaux solaires pour égaler la puissance d'une centrale nucléaire d'une puissance d'1 GW par exemple) et ne fonctionnent pas en permanence car sont tributaires de l'ensoleillement et du vent. En effet, les installations solaires photovoltaïques ont en moyenne un facteur de charge (= pourcentage du temps sur une année où ces installations fonctionnent effectivement) de 15% et les parcs éoliens français 20%.
Par conséquent, à côté des énergies renouvelables, il est nécessaire de stabiliser la fréquence du réseau à 50 Hz :
Soit en ayant des moyens de stockage de cette électricité colossaux, via des batteries (trop onéreuses pour l'heure, sans compter le coût d'adaptation du réseau électrique) ou des STEP (Station de Transfert d'Energie par Pompage) par exemple
Soit en couplant ces énergies à des centrales électriques conventionnelles (charbon, pétrole, gaz ou nucléaire) : cette deuxième option, beaucoup moins onéreuse, devrait privilégier la technologie nucléaire, la seule offrant un moyen décarboné de production d'électricité. C'est le choix fait actuellement par la France pour produire son électricité. Ce mix électrique {renouvelable + nucléaire} est décarboné à plus de 90%.
= Merci à athrun pour avoir contribué à l'élaboration de cette fiche =