I. Molécules de la chimie organique
1. Notion de chimie organique
Définition :
Les molécules de la chimie organique sont principalement constituées des éléments carbone () et hydrogène ().
Ces molécules peuvent également renfermer de l'oxygène (), de l'azote (), voire certains halogènes (tel que le chlore ).
Ce sont des molécules dont les atomes sont liés par des liaisons covalentes.
Historiquement : composé du vivant.
Actuellement : composé de carbone () (sauf , , etc.) avec de l'hydrogène (),
de l'oxygène () et/ou de l'azote ().
Cette forme de chimie sert à analyser et à synthétiser les corps organiques.
2. Groupes caractéristiques et famille chimique
Pour savoir comment trouver la valence des atomes, il est nécessaire de réviser la fiche suivante :
Les molécules et les ions, entités plus stables chimiquement
Rappel : une liaison covalente est une mise en commun de deux électrons de la couche externe.
Cas de l'atome de carbone :
Son numéro atomique est , ce dernier a donc électrons, répartis de la façon suivante : () ; ce dernier a donc électrons de valence.
Pour satisfaire à la règle de l'octet, l'atome de carbone doit donc compléter sa dernière sous-couche () avec électrons en mettant en commun ses quatre électrons de valence avec d'autres atomes : il est tétravalent et ses quatre liaisons simples s'orientent dans l'espace en faisant entre elles des angles d'environ 109° :
Remarque : un hydrocarbure saturé ne contient que des atomes de carbone tétragonaux. Sinon, il est insaturé.
Une molécule organique, autre que celle d'un hydrocarbure, est constituée :
Du squelette carboné (c'est-à-dire de l'enchaînement des atomes de carbone constituant la molécule), ne comportant que du carbone et de l'hydrogène ;
D'un ou plusieurs groupe(s) caractéristique(s) comptant au moins un atome autre que et (par exemple , , , etc.).
Groupe caractéristique et famille chimique :
Un groupe caractéristique est un groupe d'atomes qui donne des propriétés spécifiques aux molécules qui le possèdent.
On dit que ces molécules (ayant le même groupe caractéristique) forment une famille chimique.
3. Formules chimiques
Formule brute :
La formule brute d'une molécule organique indique les atomes la constituant et leurs quantités respectives.
Exemple : la formule brute du butane s'écrit .
Formule semi-développée plane :
La formule semi-développée d'une molécule organique indique les atomes la constituant sans leurs doublets et les liaisons avec les atomes d'hydrogène () ne sont pas représentées.
Exemple : la formule semi-développée du butane s'écrit .
Formule topologique :
La formule topologique représente la chaîne carbonée par une ligne brisée. Chaque extrémité de segment représente un atome de carbone portant autant d'atomes d'hydrogène qu'il est nécessaire pour satisfaire à la règle de l'octet. Les atomes autres que sont représentés de manière explicite ainsi que les atomes d'hydrogène qu'ils portent (par exemple un groupement ).
Exemple : (le butane) se représente de la manière suivante sous forme topologique :
Remarque : il existe d'autres manières d'écrire les formules chimiques des molécules organiques :
Formule de Lewis : on y voit les atomes ainsi que leurs doublets liants et non-liants. Si nécessaire, aller réviser la fiche suivante :
Représentation de Lewis et géométrie des molécules et des ions
Formule développée plane : elle est identique à la formule de Lewis, mais les doublets non-liants ne sont pas visibles. Elle précise la nature et l'ordre d'enchaînement des liaisons entre les différents atomes d'une molécule.
II. Les chaînes carbonées saturées
1. Définitions
On appelle chaîne carbonée principale la partie linéaire du squelette la plus longue. C'est elle qui va définir le nom de l'hydrocarbure.
Une liaison simple est dite saturée. Une chaîne carbonée qui ne comporte que des liaisons simples "" est saturée et les carbones sont tétragonaux.
Une chaîne est linéaire quand un carbone est lié au plus à deux carbones (si le squelette ne comporte que des atomes alignés).
Une chaîne est dite ramifiée lorsqu'elle est composée au moins d'un carbone lié à trois ou quatre atomes de carbone (on a donc des groupes d'atomes sur la chaîne principale).
Enfin, on parle d'une chaîne cyclique quand elle ne comporte que des carbones liés à au moins deux autre carbone (on observe alors une chaîne fermée en forme de polygone).
2. Les alcanes à chaîne linéaire : nomenclature
Formule brute de l'alcane à chaîne linéaire :
Les alcanes constituent la famille des molécules de formule brute de la forme :
( étant un nombre entier)
Nomenclature : leur nom est constitué d'un radical qui dépend de la longueur de la chaîne suivi du suffixe "-ane". Les quatre premiers termes ont des noms usuels :
Méthane : ;
Éthane : ;
Propane : ;
Butane : .
Les termes suivants ont un nom formé d'un préfixe qui indique le nombre d'atomes de carbone et du suffixe "-ane" :
Pentane : ;
Heptane : .
3. Le groupe substituant : les alkyles
Formule brute de l'alkyle :
L'alkyle est un substituant qui dérive d'un alcane en retirant à ce dernier un hydrogène. Sa formule brute est :
Son nom dérive de celui de l'alcane ayant le même nombre de carbone(s) : on remplace le suffixe "-ane" par "-yle".
Exemple : est le groupement méthyle.
4. Nomenclature des alcanes ramifiés
Alcane ramifié :
Lorsque les alcanes sont constitués d'une chaîne linéaire carbonée sur laquelle sont liés les alkyles : on dit qu'ils sont ramifiés.
On repère la chaîne la plus longue car le radical dépend du nombre d'atomes de cette chaîne. On ajoute ensuite un préfixe qui permet de nommer les ramifications.
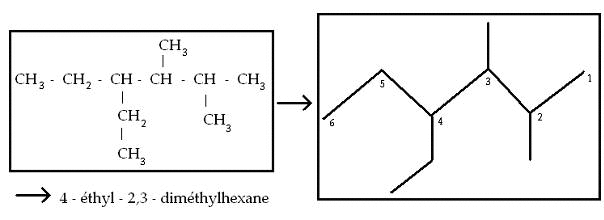
Exemple :
Méthode : on peut donner un nom à l'espèce ci-dessus. Pour ce faire, il faut, dans l'ordre :
Trouver une chaîne avec le plus grand nombre de carbones possible (ici, il y en a : c'est donc un composé de l'hexane).
Reconnaître des groupes alkyles existants. On remarque alors qu'au deuxième carbone en partant de la droite ainsi qu'au troisième, on reconnaît un groupe "Méthyl". De même, il y a un groupe "Ethyl" au quatrième carbone.
On peut alors donner le nom suivant : 4-éthyl-2,3-diméthylhexane (on dit diméthyl car il y a deux groupes "Méthyl").
5. Les cycloalcanes
On ajoute le préfixe "cyclo" devant le nom de l'alcane linéaire.
Exemple : le cyclohexane (sa formule topologique est un hexagone).
= Merci à shadowmiko / JBT pour avoir contribué à l'élaboration de cette fiche =