Une transformation physique, appelée changement d’état, peut avoir lieu lorsque de la matière reçoit ou libère de l’énergie thermique.
I Les changements d’état
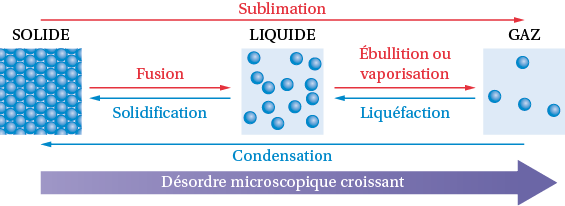
Le changement d’état d’une espèce chimique solide, liquide ou gazeuse est son passage à un autre état physique ; on parle d’une transformation physique.
Un changement d’état n’affecte pas la structure des espèces chimiques mais seulement l’organisation de celles-ci à l’échelle microscopique.
Exemple : Les molécules H2O sont ordonnées dans la glace et en mouvement désordonné dans l’eau liquide.
Le changement d’état d’un corps pur à une pression donnée a lieu à une température fixe, appelée température de changement d’état.
Exemple : À la pression atmosphérique : Tfusion (eau) = Tsolidification (eau) = 0 °C
Un changement d’état est symbolisé par une équation.
Repère
À noterL’état physique est symbolisé par une lettre : solide (s), liquide (), gaz (g).
Exemple : Équation de vaporisation de l’éthanol :
II Énergie massique de changement d’état
Une transformation physique est : endothermique si elle absorbe de l’énergie thermique ; exothermique si elle libère de l’énergie. La fusion et la vaporisation sont endothermiques ; la liquéfaction et la solidification sont exothermiques.
L’énergie massique Em de changement d’état d’une espèce chimique, exprimée en joules par kilogramme (J · kg−1), est l’énergie thermique transférée lors du changement d’état d’un kilogramme de cette espèce à sa température de changement d’état. La relation entre l’énergie massique Em, la masse m d’espèce subissant le changement d’état et l’énergie E nécessaire à cette transformation est :
Em =
Exemple : Énergie massique de fusion de la glace à 0 °C : Efusion = 330 kJ · kg−1.
MéthodeExploiter la relation entre l’énergie transférée et l’énergie massiqueL’énergie massique de vaporisation de l’eau est :
Em (vaporisation) = 2,25 kJ · g−1 à 100 °C.
a. Écrire l’équation de vaporisation de l’eau.
b. Expliquer ce que représente l’énergie massique fournie.
c. Pourquoi la valeur de cette énergie massique est-elle donnée à 100 °C ?
d. Calculer l’énergie à apporter pour vaporiser un quart de litre d’eau à 100 °C.
e. S’agit-il d’une transformation endothermique ou exothermique ? Justifier.
Repère
Conseilsa. à c. Utilisez les définitions d’un changement d’état et de son énergie massique.
d. Utilisez la relation : Em = .
Solutiona. Équation de vaporisation de l’eau :
b. L’énergie massique de vaporisation représente l’énergie à apporter à un kilogramme d’eau liquide à 100 °C pour la transformer en un kilogramme d’eau à l’état de vapeur (gaz) à 100 °C.
c. L’énergie massique de vaporisation est donnée à 100 °C car c’est la température à laquelle a lieu ce changement d’état à la pression atmosphérique.
d. Un quart de litre d’eau (0,250 L) a une masse :
m = 0,250 kg = 250 g.
La relation Em = conduit à E = Em × m.
Avec Em = 2,25 kJ · g−1 et m = 250 g, on obtient :
E = 2,25 × 250 = 563 kJ.
Il faut apporter une énergie de 563 kJ pour faire passer 250 g d’eau liquide initialement à 100 °C à l’état de vapeur d’eau à 100 °C.
À noterCette énergie ne change pas la température de l’eau, mais simplement son état physique.
e. La vaporisation est une transformation endothermique puisqu’il faut apporter de l’énergie à l’eau pour que le changement d’état se produise.