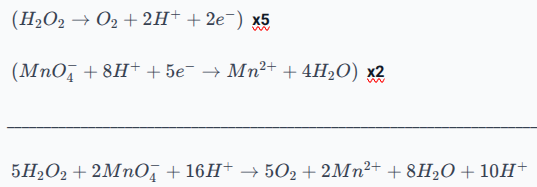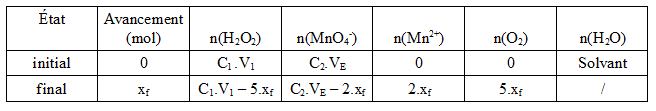I. Prérequis : avancement d'une réaction et mélange stœchiométrique
Un titrage (ou dosage) fait appel à une transformation (ou réaction) chimique.
Aussi est-il recommandé de réviser la fiche suivante (en particulier, le §II.4) :
Modélisation de l'évolution d'un système chimique : notion d'avancement
II. Notion de dosage ou de titrage d'une solution
1. Notion
Titrer ou doser une espèce chimique dans une solution, c'est déterminer sa quantité de matières et/ou sa concentration en quantité de matière (ou molaire) dans cette solution.
2. Les principales sortes de dosages
Il existe plusieurs méthodes de détermination de la concentration molaire d'espèces chimiques en solution. Voici les principales :
Dosage colorimétrique ;
Dosage conductimétrique ;
Dosage pH-métrique ;
Dosage potentiométrique.
Seule la première méthode est étudiée en classe de première, la deuxième et la troisième en classe de terminale et la dernière pendant les études post-bac.
III. Principe d'un dosage
1. Matériel utilisé
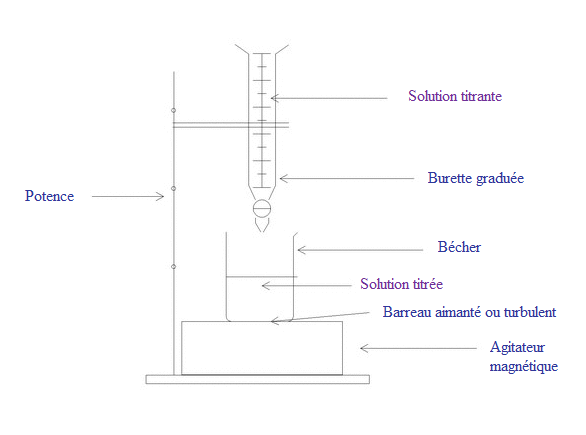
Le matériel utilisé pour effectuer un dosage est le suivant :
1 burette graduée ;
1 agitateur magnétique avec son barreau aimanté ;
1 bécher (ou un erlenmeyer) ;
1 pot poubelle ;
1 pipette jaugée et sa poire aspirante (pro-pipette).
Souvent, il faut diluer une solution pour pouvoir effectuer le dosage de celle-ci dans de bonnes conditions. Il est donc vivement conseillé de lire la fiche réviser la fiche suivante :
Les solutions aqueuses : dissolution, dilution et dosage par étalonnage
Remarque importante : la méthode de dilution d'une solution connaissant sa concentration en masse (ou massique) est identique lorsqu'on connaît sa concentration en quantité de matière (ou molaire).
2. Solution titrante - solution titrée
Définition :
La solution titrante est une solution dont on connaît la concentration molaire. On la verse dans la burette graduée.
La solution titrée est une solution, diluée ou non, dont on ignore la concentration molaire (qu'on cherche donc à déterminer). Son volume est mesuré avec la pipette jaugée : il est donc connu. On verse ensuite la solution dans le bécher.
3. Mode opératoire pour un dosage
Le mode opératoire explicité par la suite est à suivre scrupuleusement lors des travaux pratiques :
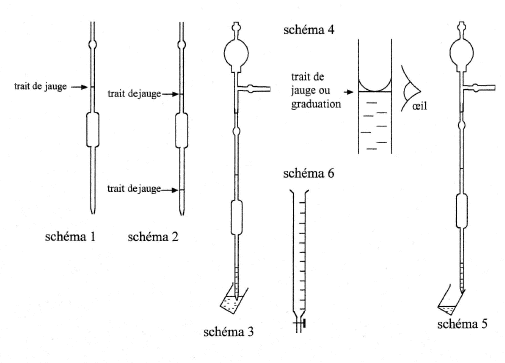
Pour mesurer les volumes des solutions à titrer, on utilise des pipettes jaugées de 10 mL, 20 mL, etc. et des poires aspirantes ou propipettes. Il existe des pipettes à 1 trait de jauge () et des pipettes à 2 traits de jauge ().
On ne pipette jamais directement dans le flacon ; il faut d'abord verser la solution dans un bécher.
Rincer la pipette avec un peu de solution puis prélever un volume V de cette solution.
Tenir la pipette verticale pour que le niveau du liquide soit parallèle au trait de jauge () et aspirer la solution. Il faut ajuster le niveau de la solution au trait de jauge : placer les yeux à la hauteur du trait pour une bonne visée () et maintenir la pipette verticale au contact du bécher penché afin d'atteindre la précision maximale de mesure.
Ensuite, il faut verser la solution prélevée dans un autre bécher en faisant couler cette solution le long de la paroi du bécher ().
Pour mesurer les volumes des solutions titrantes, on utilise des burettes graduées de 25 mL, 50 mL, etc. (). Il faut d'abord rincer la burette avec la solution titrante puis remplir la burette en n'oubliant pas de remplir son bec et effectuer la mise à niveau de la solution devant la graduation zéro en utilisant un pot poubelle.
Attention, lorsqu'on ajuste le niveau de la solution devant le trait de jauge ou le zéro de la burette, il faut éviter les erreurs de parallaxe et mettre l’œil devant la surface libre de la solution ().
Il faut agiter la solution titrée pendant tout le dosage :
On utilise un agitateur magnétique et son barreau aimanté ou turbulent que l'on place dans le bécher.
Il faut régler la vitesse de rotation du barreau aimanté : il ne doit pas y avoir de projections.
A la fin du dosage, toute la verrerie utilisée (béchers, pipettes, burettes, ...) ainsi que le barreau aimanté doivent être rincés avec de l'eau distillée.
4. Schéma de principe du dosage d'une solution
IV. Détermination de la concentration molaire d'une solution titrée
1. Notion d'équivalence
Au début du dosage, à chaque ajout de solution titrante, le réactif de la solution titrante est consommé et la quantité de réactif titré dans le bécher diminue peu à peu. Le réactif titrant est donc le réactif limitant.
Pour un certain volume versé de solution titrante, les deux réactifs sont tous deux entièrement consommés.
Si on continue de verser de la solution titrante, il n'y a plus de réaction : le réactif titrant versé ne réagit plus avec le réactif titré. Le réactif titré devient donc le réactif limitant.
Ce changement de réactif limitant définit l'équivalence du dosage. Le volume de la solution titrante versé à l'équivalence est appelé volume équivalent.
Définition :
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stœchiométriques.
Ainsi pour une réaction de titrage d'équation-bilan (où est le réactif titré et le réactif titrant), on a à l'équivalence :
2. Propriété du dosage
Une réaction de dosage doit être
Rapide ;
Quantitative : la réaction doit être quasi-totale ;
Spécifique à l'espèce dosée : le réactif titré contenu dans le bécher ne doit réagir qu'avec le réactif titrant versé dans la burette.
V. Les différentes sortes de dosages
1. Dosage colorimétrique
Un dosage colorimétrique est possible lorsque l'une des espèces chimiques intervenant dans la réaction du dosage possède une couleur caractéristique, les autres étant incolores.
Exemple : dosage du diiode () dans un désinfectant par une solution de thiosulfate de sodium ().
Les couples en jeu sont et ;
L'équation de la réaction du dosage est :
___________________________________
Seul le diiode est une espèce colorée (de couleur marron-jaune suivant la dilution), donc à l'équivalence tout le contenu dans le bécher a réagi avec le versé : la solution devient subitement incolore.
On peut alors déterminer le volume équivalent par lecture de la burette graduée (quantité de thiosulfate de sodium versée).
Remarque : en terminale, il sera possible d'utiliser des indicateurs colorés pour repérer l'équivalence.
2. Dosage conductimétrique (hors programme)
La mesure de la conductivité de la solution titrée dans le bécher permet - grâce à un conductimètre et un ordinateur - de tracer la courbe :
Le volume pour lequel la conductivité est minimale correspond au point équivalent : ce point, intersection des deux droites tracées a pour abscisse le volume équivalent .
Remarque : il est possible de déterminer les pentes de chaque droite par le calcul.
Exemple : dosage de l'ion par l'ion .
3. Dosage pH-métrique (hors programme)
Cette étude sera faite en classe de terminale.
Voir la fiche Analyse physico-chimique d'un système chimique
4. Dosage potentiométrique (hors programme)
Cette étude sera faite pendant les études supérieures.
VI. Exemple de dosage colorimétrique
1. Énoncé
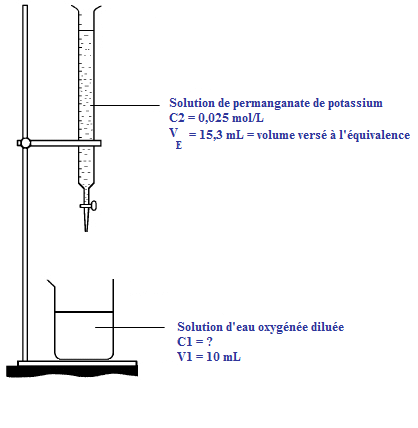
Une solution commerciale d'eau oxygénée est diluée au centième.
On réalise le dosage de de la solution diluée par une solution acidifiée de permanganate de potassium à .
Il faut alors verser de la solution de permanganate de potassium pour que la coloration violette persiste.
1. Faire le schéma annoté du dosage.
2. Écrire l'équation-bilan de la réaction du dosage.
3. Comment repère-t-on expérimentalement l'équivalence ?
4. Pourquoi la réaction doit-elle se faire en milieu acide ?
5. Déterminer la concentration de la solution diluée.
6. En déduire la concentration de la solution commerciale.
2. Correction
1. Schéma annoté du dosage :
2. Les couples en jeu sont et .
réagit avec donc l'équation-bilan s'écrit :
L'équation de la réaction du dosage est donc, une fois simplifiée,
3. Avant l'équivalence, si on ajoute du permanganate de potassium dans le bécher, celui-ci réagit avec l'eau oxygénée pour donner l'ion manganèse (II) avec de l'eau.
La solution contenue dans le bécher reste incolore puisque seul a une couleur caractéristique (le violet) et qu'il réagit.
A l'équivalence, tout le a réagi avec le versé : la solution est encore incolore. Mais l'ajout d'une goutte supplémentaire de permanganate de potassium engendrera la persistance de la coloration violette, ce dernier se trouvant alors en excès.
C'est ainsi qu'on repère expérimentalement l'équivalence.
4. Il suffit de regarder l'équation de la réaction du dosage pour voir que cette réaction se fait en présence d'ions , donc en milieu acide.
5. Il existe deux méthodes pour déterminer la concentration de la solution diluée.
1re méthode : utilisation de l'équation de la réaction du dosage :
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stœchiométriques.
Donc à l'équivalence,
(on divise par le coefficient stœchiométrique de chaque réactif)
2e méthode : utilisation d'un tableau d'avancement
A l'équivalence, l'avancement de la réaction est et tous les réactifs ont réagi :
On retrouve finalement la relation
Donc, la concentration de la solution diluée vaut mol/L
6. L'énoncé nous dit que "la solution commerciale d'eau oxygénée est diluée au centième".
Si on note cette concentration, alors on a
La concentration de la solution commerciale vaut mol/L.
= Merci à gbm / Kaela pour avoir contribué à l'élaboration de cette fiche =