I. Étude qualitative des transformations chimiques : rappels
1. Prérequis
Les notions liées à l'étude qualitative des transformations (ou réactions) chimiques ont été abordées en classe de seconde.
Aussi est-il recommandé de réviser la fiche suivante :
Cette première partie ne propose qu'une synthèse des principales notions à retenir.
2. Notion d'évolution d'un système chimique
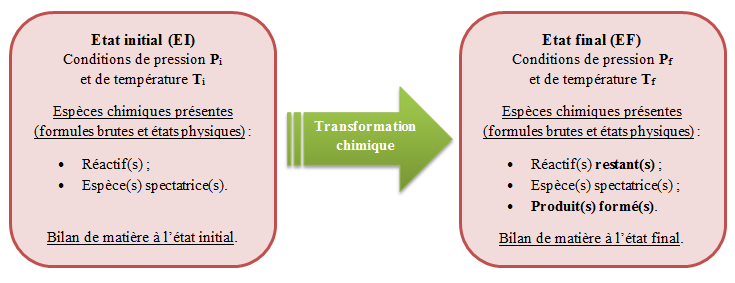
Un système chimique (ou milieu réactionnel) est un mélange d'espèces chimiques qui sont susceptibles de réagir entre elles.
Pour caractériser un système chimique, il est nécessaire de définir l'ensemble des paramètres le constituant, c'est-à-dire :
Les conditions de réalisation de la transformation : la température et la pression ;
Toutes les espèces chimiques mises en jeu avec, pour chacune d'elles, leurs formules brutes et leur(s) état(s) physique(s) ;
Les quantités de matière de chacune des espèces chimiques mises en jeu (= bilan de matière).
Tous ces paramètres définissent ce qu'on appelle l'état d'un système chimique.
Remarque : les transformations chimiques usuelles se font généralement à l'air libre (sous la pression atmosphérique).
La transformation (ou réaction) chimique est une évolution d'un système chimique au cours de laquelle des espèces chimiques disparaissent (= réactifs), tout en laissant apparaître de nouvelles espèces chimiques (= produits) ;
Cette caractérisation de l'évolution est permise par la comparaison d'un état initial avec un état final, lorsqu'il n'y a plus de réaction ;
Les espèces chimiques présentes dans le système mais n'étant pas affectées par la transformation sont dites spectatrices.
3. Caractérisation d'une transformation chimique
"Rien ne se perd, rien ne se créé, tout se transforme" une transformation chimique est caractérisée par une conservation de la matière. Elle se traduit de deux manières :
Conservation de la masse totale du système (autrement dit, conservation du nombre d'atomes des éléments chimiques constituant le système) ;
Conservation de la charge globale du système.
L'équation d'une réaction chimique permet d'établir le bilan des réactifs intervenant dans cette transformation et les produits formés par cette réaction :
Par le biais de leur formules chimiques ;
En précisant l'état physique de chaque espèce intervenant dans la réaction : solide , liquide , gazeux ou aqueux ;
En indiquant également les proportions des quantités qui interviennent (mais pas les conditions de pression et de température dans lesquelles se déroule la réaction).
Exemple : soit l'équation générale d'une réaction chimique .
A l'échelle microscopique : espèce(s) chimique(s) (atome(s), molécule(s) ou ion(s)) réagissent avec espèce(s) chimique(s) pour former espèce(s) chimique(s) et espèce(s) chimique(s) ;
A l'échelle macroscopique : mole(s) de l'espèce chimique réagissent avec mole(s) de l'espèce chimique . Il se forme mole(s) de l'espèce chimique et mole(s) de l'espèce chimique .
Remarque importante : les espèces spectatrices, qui n'interviennent pas dans la réaction (c'est-à-dire ne réagissent pas) ne doivent pas apparaître dans l'équation-bilan.
L'équation-bilan étant représentative de la transformation étudiée, la propriété de conservation de la matière (en masse et en charge) doit donc être respectée la méthode d'équilibrage d'une équation-bilan doit donc être parfaitement maîtrisée !
En conséquence, il est nécessaire d'introduire devant chaque espèce chimique intervenante un nombre qu'on peut ajuster pour traduire cette conservation : on l'appelle le coefficient stœchiométrique.
L'analyse des proportions entre les espèces engagées (= réactifs) et les espèces formées (= produits) est la stœchiométrie.
II. Étude quantitative des transformations chimiques
1. Notion d'avancement d'une réaction
Définition :
L'avancement de la réaction, noté , exprimé en mol, permet de suivre l'évolution des quantités de matières des réactifs et des produits au cours de la transformation chimique.
Pour une équation chimique du type :
si l'avancement de la réaction est , c'est que les quantités de réactif et de réactif ont été consommées ;
simultanément, les quantités du produit et du produit ont été formées.
Lors de son arrêt, une transformations chimique est dite totale lorsque qu'un réactif a complètement disparu (ou entièrement réagi) : il est appelé réactif limitant.
2. Représentation d'une évolution : tableau d'avancement d'une réaction
Définition :
Le tableau d'avancement d'une réaction est un outil permettant de rendre compte de l'évolution des quantités de matière du système chimique étudié, de l'état initial à l'état final.
En ce sens il permet d'établir le bilan de matière des espèces chimiques mises en jeu au cours du temps.
Étude de l'état initial (à ) :
On indique dans chaque case du tableau les quantités de matière initiales des réactifs dont on dispose ;
La transformation chimique n'ayant pas encore commencé, les quantités de matières initiales des produits sont généralement nulles, mais ce n'est pas toujours le cas !
Étude de l'état intermédiaire (à un instant ) :
Il se remplit facilement en faisant attention aux coefficients stœchiométriques !
Les quantités de réactif et de réactif ont été consommées on les soustrait donc à leurs quantités de matière initiales respectives ;
simultanément, les quantités du produit et du produit ont été formées on les ajoute donc à leurs quantités de matière initiales respectives ;
Rappel : quand rien n'est indiqué devant une espèce chimique, le coefficient stœchiométrique vaut 1.
Étude de l'état final (à ) :
L'objectif est de déterminer quel réactif va être en défaut (c'est-à-dire celui qui va disparaître en premier et qui va stopper la transformation) ;
Si on ne sait pas, on va définir un état théorique appelé état d'avancement maximal dans lequel on va postuler que tous les réactifs ont entièrement réagi : leurs quantités de matières sont donc supposées nulles ;
On choisit le plus petit des avancements maximaux calculés on en déduit le ou les réactif(s) limitant(s) ;
Connaissant cela, on en déduit la quantité de matière finale du réactif ayant été partiellement consommée : on dit que ce réactif est en excès ;
On peut enfin déterminer les quantités de matière des produits formés au cours de la transformation.
:
L'état maximal () n'est pas systématiquement atteint !
C'est un état théorique qui permet de déterminer le ou les réactif(s) limitant(s) ;
Seul l'état final correspondant à est réel.
3. Transformation totale ou non totale ?
Une transformation totale s'arrête quand l'un (au moins) des réactifs a entièrement réagi, c'est le réactif limitant.
L'avancement final d'une réaction, noté , est l'avancement mesuré expérimentalement lorsque plus aucune évolution du système chimique n'est observée (c'est-à-dire plus de réaction constatée).
Lorsqu'une transformation totale s'arrête, l'avancement final est - dans ce cas - maximal :
Pour établir l'équation-bilan d'une transformation totale, on mettra une simple flèche pour préciser le sens préférentiel de la transformation chimique :
A contrario, la transformation est dite non totale (ou limitée ou équilibrée) dès lors que l'avancement final de la réaction est inférieur à l'état maximal calculé théoriquement :
Dans l'état final de la transformation, les quantités de matière des réactifs et des produits n'évoluent plus : on dit qu'il y a coexistence des produits et de tous les réactifs.
Pour établir l'équation-bilan d'une transformation non totale, on utilise une double flèche (voire le signe égal) pour préciser l'état d'équilibre de la transformation chimique :
4. Cas particulier : mélange initial stœchiométrique
Définition :
Un mélange initial est dit stœchiométrique si les quantités de matière initiales des réactifs ont été introduites dans les proportions de leurs coefficients stœchiométriques.
Dans ce cas particulier, à l'état final, tous les réactifs ont entièrement réagi, leurs quantités de matières sont donc nulles.
Exemple d'application classique : cette propriété est utilisée pour des titrages (ou dosages) d'une solution, de manière à en déduire sa concentration initiale. Pour plus d'explications, se référer à la fiche correspondante :
III. Exemple d'application : les rails de chemin de fer
1. Énoncé du problème
Des rails de chemins de fer peuvent être soudés par l'aluminothermie : de l'oxyde de fer est réduit par de l'aluminium pour donner du fer et de l'alumine .
Cette réaction se produit à haute température (près de ) et produit du fer métallique d'une grande pureté.
a. Écrire l'équation de la réaction, supposée totale.
b. On introduit 32,0 g de et 5,40 g d'. Déterminer les quantités de matière apportées de ces réactifs.
c. Quel est le réactif limitant ?
d. Déterminer la composition finale du système.
e. Déterminer les masses de fer et d'alumine obtenues par la réaction.
2. Analyse de l'énoncé
Les informations importantes fournies par l'énoncé sont les suivantes :
On connaît les formules espèces chimiques consommées côté réactifs ( et ) et celle formées côté produits ( et ).
Cela va donc nous permettre de déterminer les masses molaires de ces espèces chimiques à partir de la classification périodique des éléments (généralement, c'est fourni par l'énoncé).
Enfin, il est stipulé que la réaction est supposée totale, ce qui va nous conduire à déterminer l'avancement maximal de la réaction.
3. Résolution du problème
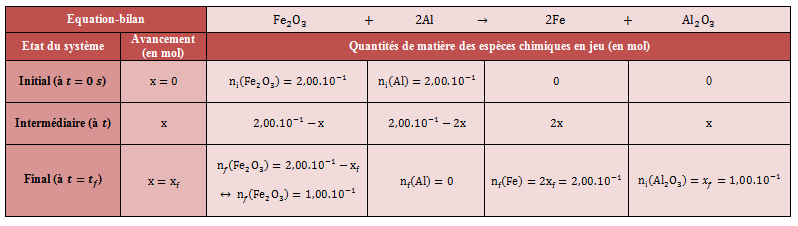
Question a. L'équation de la réaction d'aluminothermie est :
Remarques :
L'énoncé ne fournit aucune indication sur l'état physique de chaque espèce chimique intervenant dans la réaction, on ne le précise donc pas.
Bien s'assurer que l'équation-bilan est bien équilibrée ! En effet, toute erreur commise à cette étape aura une incidence sur le tableau d'avancement de la réaction rempli !
Étant donné que la réaction est supposée totale, on connaît le sens préférentiel de la transformation, d'où la flèche simple.
Question b. Cherchons à déterminer les quantités de matière initiales des réactifs intervenant dans la réaction.
Pour ce faire, il est nécessaire dans un premier temps de déterminer les masses molaires de l'aluminium et de l'oxyde de fer, par le biais de la classification périodique des éléments :
Ainsi, les quantités de matière initiales sont :
Question c. Pour déterminer le réactif limitant, nous allons étudier l'état théorique maximal : à l'état maximal, tous les réactifs ont entièrement réagi, leurs quantités de matières sont supposées nulles
Pour déterminer le réactif limitant (et donc l'avancement final de la réaction), on choisit le plus petit des avancements calculés :
L'aluminium est donc le réactif limitant.
Question d. Pour déterminer la composition finale du mélange réactionnel, établissons le tableau d'avancement de la réaction :
Question e. Cherchons à déterminer les masses finales des produits formés par la réaction.
Pour ce faire, il est nécessaire dans un premier temps de déterminer les masses molaires du fer et de l'oxyde d'aluminium, par le biais de la classification périodique des éléments :
Ainsi, d'après le tableau d'avancement de la réaction et par définition de la quantité de matière :
Finalement, les masses formées en fer et en oxyde d'aluminium sont respectivement de 11,2 g et 10,2 g.
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =