I. Les ondes électromagnétiques
1. Caractéristiques d'une onde électromagnétique
Onde électromagnétique :
Une onde électromagnétique est le phénomène de propagation d'une vibration électrique et magnétique dans un milieu matériel ou dans le vide sans transport de matière.
Elle résulte d'un champ électrique et d'un champ magnétique dont les amplitudes varient de façon sinusoïdale au cours du temps. L'amplitude d'une onde électromagnétique varie donc de façon sinusoïdale au cours de sa propagation.
Remarques :
Une onde électromagnétique est dite sinusoïdale si, en tout point du milieu de propagation, l'onde est une fonction sinusoïdale du temps.
La propagation dans le vide est propre à une onde électromagnétique : ce n'est pas le cas pour une onde mécanique qui nécessite un milieu matériel pour se propager !
La propagation d'une onde électromagnétique se fait dans une région sans charges ni courants.
En optique, la direction de propagation de l'onde est celle du rayon lumineux.
Exemple : une onde électromagnétique peut être produite par un courant électrique variable.
Propriété :
Une onde électromagnétique se propage à partir de la source dans toutes les directions qui lui sont offertes.
Propriété :
Une onde électromagnétique transporte de l'énergie sans transport de matière. Cette énergie a été fournie par la source au milieu matériel ou au vide.
Propriété :
La vitesse (ou célérité) d'une onde électromagnétique dans un milieu matériel ne dépend pas de l'amplitude de la déformation. Elle est caractéristique de ce milieu.
Un phénomène est périodique dans le temps s'il se répète, identique à lui-même, régulièrement au cours du temps. Ainsi, une onde électromagnétique sinusoïdale est périodique : en un point quelconque du milieu de propagation, l'onde est périodique au cours du temps.
Période temporelle :
La période temporelle ou période d'un phénomène périodique est la plus petite durée au bout de laquelle le phénomène se reproduit identique à lui-même.
La fréquence est le nombre de fois que le phénomène périodique se reproduit, identique à lui-même, pendant une seconde :
Période spatiale :
La période spatiale ou longueur d'onde d'une onde électromagnétique est la plus courte distance de répétition de cette onde. C'est donc la distance parcourue par cette onde pendant une période temporelle . Ainsi, la longueur d'onde d'une onde sinusoïdale est donc sa période spatiale.
La longueur d'onde est la distance parcourue par l'onde sinusoïdale pendant une période de cette onde sinusoïdale ; si est la vitesse (ou célérité) de propagation de l'onde, alors :
Remarques :
La fréquence et donc la période est caractéristique de l'onde. C'est une grandeur caractéristique de la source qui émet l'onde.
La vitesse (ou célérité) de l'onde électromagnétique dépend du milieu de propagation la longueur d'onde n'est pas caractéristique de l'onde.
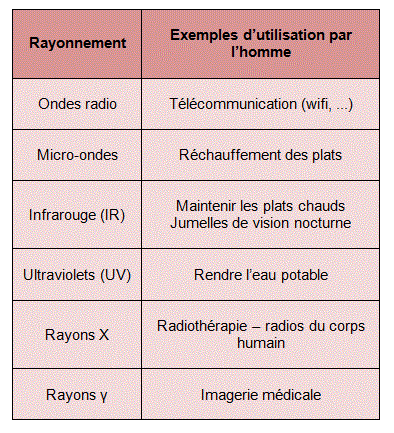
2. Les différents domaines des ondes électromagnétiques
En fonction de la valeur de sa fréquence (voire de la valeur de sa longueur d'onde), une onde électromagnétique appartient à un domaine spécifique :
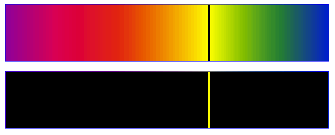
Spectre électromagnétique (d'après UC Davis ChemWiki, CC-BY-NC-SA 3,0)
Remarques :
Le domaine de la lumière visible ne constitue qu'un cas particulier des ondes électromagnétiques et ne représente qu'une infime partie de ce spectre. Pour ce domaine, on aura tendance à parler d'onde lumineuse.
Contrairement au son (), les domaines de fréquence de la lumière visible sont beaucoup plus élevés : .
Selon la fréquence ou la longueur d'onde utilisée, l'application du rayonnement électromagnétique sera différente :
Remarque : les micro-ondes portent mal leur nom puisque ce sont des ondes de l'ordre du !
II. La mécanique newtonienne et ses limites
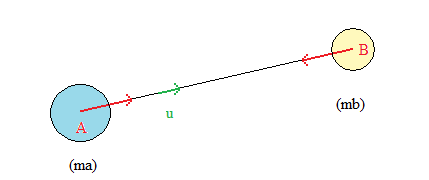
1. La force gravitationnelle : loi de gravitation universelle
Loi de Newton (rappel) :
"Deux corps et B répartition sphérique de masse, de masses et , dont les centres sont séparés par la distance , exercent l'un sur l'autre des forces attractives de même valeur, proportionnelles aux masses et inversement proportionnelles au carré de la distance qui les séparent" :
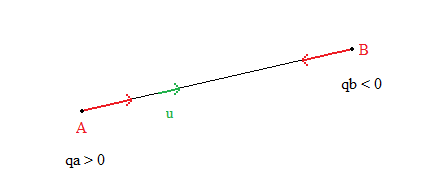
2. La force électrostatique : la loi de Coulomb
Loi de Coulomb (rappel) :
"Deux charges ponctuelles et , placées aux points et distants de , exercent l'une sur l'autre des forces répulsives pour des charges de même signe, attractives pour des charges de signes contraires, de même valeur" :
3. Remarque
Dans un atome, par exemple dans l'atome d'hydrogène, la force gravitationnelle est négligeable par rapport à la force électrostatique qui agit sur l'électron.
4. Comparaison des systèmes planétaires et des cortèges électroniques des atomes
Les systèmes planétaires et les atomes présentent une grande similitude : un objet central autour duquel se déplacent d'autres objets soumis à une force centripète.
Pourtant, il existe des différences fondamentales entre ces deux systèmes :
Les systèmes planétaires présentent une grande diversité : tous les rayons orbitaux sont possibles pour les planètes et les satellites.
Tous les atomes d'un même élément chimique sont identiques, ils ont tous le même rayon. Par conséquent, les électrons occupent un espace identique pour tous les atomes d'une même espèce chimique.
La mécanique newtonienne ne permet donc pas de justifier l'identité des atomes.
III. Quantification des niveaux d'énergie électroniques d'un atome
1. Spectres atomiques
Définitions :
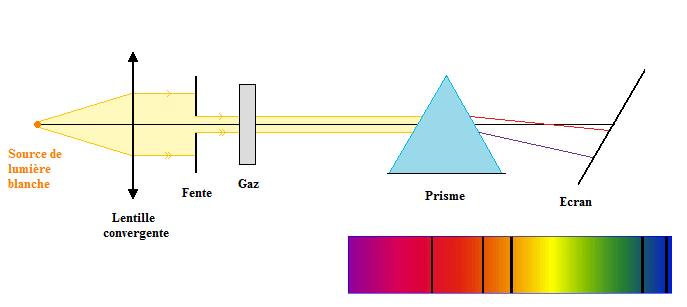
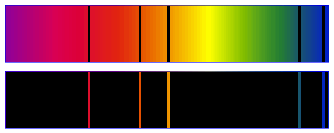
Le spectre d'une lumière est la séparation des radiations monochromatiques qui constituent cette lumière à l'aide d'un prisme.
On a un spectre de raies si la plage colorée sur l'écran est discontinue ; on dit qu'elle présente des raies.
Un spectre d'émission est le spectre de la lumière émise par de la matière excitée. En effet, la matière qui a reçu de l'énergie sous forme calorifique, électrique, mécanique, lumineuse, etc. émet de la lumière.
Un spectre d'absorption est le spectre de la lumière blanche dont certaines radiations ont été absorbées lors de la traversée d'une matière.
Exemples : spectre d'émission avec une lampe à vapeur de sodium ou de mercure :
On observe des raies colorées brillantes sur fond noir.
Ces raies colorées sont caractéristiques de l'atome excité.
Le spectre de la lumière émise par un gaz sous faible pression et à haute température (donc constitué d'atomes) est un spectre de raies.
Propriété :
Les atomes excités émettent un rayonnement pour certaines fréquences seulement (ces atomes se désexcitent en émettant de l'énergie lumineuse).
Remarque : le spectre de la lumière blanche émise par le filament incandescent d'une lampe est un spectre continu.
Spectre d'absorption :
On observe des raies noires dans le spectre de la lumière blanche (arc-en-ciel).
Ces raies noires sont celles des radiations monochromatiques qui ont été absorbées par le gaz.
Remarques :
Les fréquences des couleurs absorbées par un atome sont les mêmes que celles qui sont émises par un atome quand il est excité.
Pour le sodium :
Pour le mercure :
Le spectre devient de plus en plus compliqué quand le numéro atomique de l'atome augmente.
2. Niveaux d'énergie des atomes
Pour expliquer le "caractère discret" des fréquences émises ou absorbées par un atome (c'est-à-dire quand l'atome ne peut émettre ou absorber que certaines couleurs), des postulats ont été émis concernant l'échange d'énergie entre l'atome et la lumière.
En 1900, Max Planck a postulé : "l'énergie transportée par les ondes électromagnétiques émises ou absorbées par un atome est quantifiée, c'est-à-dire qu'elle ne peut s'échanger que par paquets ou quanta d'énergie".
En 1905, Albert Einstein a postulé : "ces quanta d'énergie sont portés par des particules appelées photons".
Pour une onde électromagnétique de fréquence , de longueur d'onde et de célérité dans le vide, l'énergie d'un photon est :
où est la constante de Planck et la célérité de la lumière dans le vide .
Le photon est un corpuscule de masse nulle, de charge nulle, qui se propage à la célérité de la lumière dans le vide ou l'air.
Unités S.I : est en ; est en ; est en ; est en ; est en .
En 1913, Niels Bohr énonce deux postulats :
1er postulat :
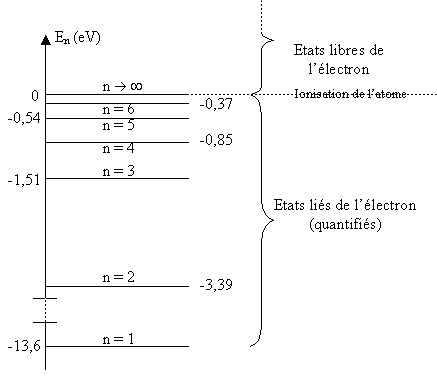
L'énergie d'un atome est quantifiée.
L'énergie d'un atome ne peut prendre que certaines valeurs bien déterminées. On dit que l'atome ne peut exister que dans un nombre discret de niveaux d'énergie.
Chaque niveau d'énergie de l'atome correspond à un état de l'atome, c'est-à-dire à une répartition des électrons autour du noyau :
L'état fondamental de l'atome est l'état de plus basse énergie pour lequel les électrons sont le plus liés au noyau.
Un état excité de l'atome est un état de l'atome qui a absorbé de l'énergie, donc pour lequel les électrons sont moins liés au noyau que dans l'état fondamental.
L'état ionisé de l'atome est l'état pour lequel l'atome a perdu un électron.
Diagramme des niveaux d'énergie d'un atome (par exemple pour l'hydrogène)
2e postulat :
Les variations d'énergie d'un atome sont quantifiées.
Le passage d'un niveau d'énergie à un autre, appelé transition, s'accompagne de l'émission ou de l'absorption d'un photon.
L'énergie du photon émis ou absorbé (constante de Planck x fréquence) est égale à la variation de l'énergie de l'atome :
Représentation avec un diagramme d'énergie
Remarque :
L'électronvolt est défini comme l'énergie cinétique acquise par un électron accéléré sous une différence de potentiel électrique (= tension) de :
L'électronvolt permet d'exprimer simplement les énergies des photons, des électrons dans un atome, ou encore les énergies de liaison entre particules. Il est donc primordial de savoir faire cette conversion d'unité !
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =