Les solutions font partie de notre quotidien et plus particulièrement les solutions aqueuses. On distingue les solutions moléculaires et ioniques. Pour déterminer leur contenu, on utilise la concentration en masse.
I Définitions
1 Solvant et soluté
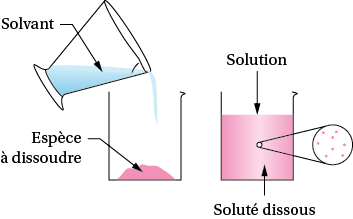
Une solution est un mélange liquide homogène de plusieurs constituants. Le solvant est le constituant majoritaire : c’est un liquide capable de dissoudre une espèce chimique (solide, liquide ou gazeuse) appelée le soluté.
Repère
À noterLors d’une dissolution la masse se conserve, mais pas le volume.
La solution est le résultat de la dissolution du soluté dans le solvant. Les entités chimiques du soluté (molécules ou ions) se dispersent parmi les molécules du solvant.
Une solution est aqueuse lorsque le solvant est l’eau.
2 Les solutions aqueuses moléculaires et ioniques
Une solution est moléculaire lorsque le soluté est dissous sous forme de molécules. L’eau sucrée est une solution aqueuse moléculaire contenant des molécules de saccharose C12H22O11.
Repère
À noterToute solution aqueuse est électriquement neutre.
Une solution est ionique lorsque le soluté est dissous sous forme d’ions. L’eau salée est une solution aqueuse ionique contenant des ions sodium et des ions chlorure . Elle a la particularité de conduire le courant.
Une solution est saturée lorsque le soluté introduit n’est pas totalement dissous. On a dépassé la solubilité du soluté. On peut dissoudre au maximum environ 400 g de sel dans un litre d’eau à 20 °C.
II Concentration en masse du soluté
La concentration en masse CA d’une espèce A en solution est égale au quotient de la masse de soluté mA dissoute sur le volume Vsol de la solution.
CA en g · L−1 ; m(A) en g ; Vsol en L. |
MéthodeDistinguer solutions aqueuses moléculaires et ioniquesOn prépare une solution aqueuse de glucose et une solution aqueuse de chlorure de potassium. Le glucose et le chlorure de potassium sont des solides blancs. On prélève une masse m = 10 g de solide pour préparer 200 mL de chaque solution.
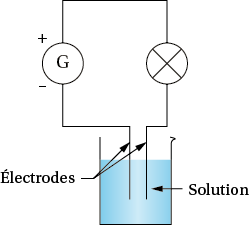
On réalise un circuit comprenant un générateur, une lampe et deux électrodes plongées dans une solution. On constate que la lampe ne s’allume pas lorsque l’on place dans le bécher de l’eau distillée ou la solution de glucose. En revanche, elle s’allume avec la solution d’eau salée.
a. Identifier le solvant et le soluté pour chaque solution.
b. Déterminer la concentration en masse de chaque solution.
c. Quelle est la solution moléculaire et la solution ionique ? Justifier.
Repère
Conseilsb. Utilisez la définition de la concentration en masse. Attention aux unités.
c. Interprétez les observations expérimentales.
Réinvestissez vos connaissances de collège sur les espèces qui permettent la conduction du courant dans les solutions.
Solutiona. L’espèce dissoute est le solide (glucose ou chlorure de potassium) appelé soluté, le solvant est l’eau car on parle de solution aqueuse.
b. La concentration en masse est : en g · L–1.
On dissout une masse msoluté = 10 g et on prépare un volume :
Vsolution = 200 mL = 0,200 L = 2,0 × 10–1 L d’où g · L–1.
c. La solution aqueuse de glucose, comme l’eau distillée ne conduisent pas le courant car la lampe ne s’allume pas. En revanche, la solution aqueuse de chlorure de potassium conduit le courant car la lampe s’allume. C’est le soluté, chlorure de potassium qui permet cette conduction puisque le solvant, l’eau, ne conduit pas.
La conduction du courant est due à la présence d’ions dans la solution. Le chlorure de potassium est un solide ionique : sa dissolution constitue une solution ionique. Le glucose est une molécule, qui ne permet pas la conduction du courant électrique et constitue une solution moléculaire.