Le schéma de Lewis d'une molécule ou d'un ion
A) La représentation des espèces chimiques
Une molécule ou un ion est en général composé de différents atomes. On les représente à l’aide d’une formule brute : cette formule indique le nombre et la nature des atomes qui constituent la molécule. Le nombre de chacun des atomes est précisé en indice à droite du symbole des atomes.
Exemples
Le méthane s’écrit CH4, il contient donc un atome de carbone et 4 atomes d’hydrogène.
L’éthanol s’écrit C2H6O, il contient donc 2 atomes de carbone, 6 atomes d’hydrogène et un atome d’oxygène. Inversement, une molécule qui contiendrait 3 atomes de carbone, 8 atomes d’hydrogène et 2 atomes d’oxygène aurait pour formule brute C3H8O2.
B) Les liaisons covalentes
Une liaison de covalence (ou doublet liant) correspond à la mise en commun de 2 électrons par 2 atomes. Chaque atome fournit un électron. Le doublet d’électrons de liaison appartient entièrement aux 2 atomes. La liaison est représentée par un trait entre les 2 atomes : C—H.
Cette mise en commun d’électrons permet à chaque atome de compléter son nombre d’électrons pour satisfaire à la règle de l’octet ou du duet, pour avoir une structure électronique stable comme le gaz rare le plus proche.
Ainsi, l’élément oxygène a 6 électrons sur sa couche externe, il doit donc établir 2 liaisons de covalence pour compléter sa couche électronique à 8 électrons en partageant 2 électrons. Il lui reste donc 4 électrons non partagés, qui ne créent pas de liaison : cela constitue donc 2 doublets non liants représentés par des traits sur les côtés de l’élément chimique.
Structure électronique de quelques atomes

Un atome va en général former autant de liaisons qu’il lui manque d’électrons pour obéir à la règle du duet ou de l’octet.
Il arrive qu’il y ait 2, voire 3 liaisons de covalence entre 2 atomes. On place alors 2 traits ou 3 traits entre les 2 atomes. Dans une molécule, tous les électrons s’associent par paire (doublet d’électrons).
C) La représentation de Lewis
La représentation de Lewis des molécules fait apparaître toutes les liaisons covalentes et tous les doublets non liants des atomes constituant la molécule.
Exemples
Exemple 1
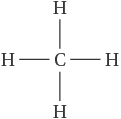
Le méthane a pour formule CH4. Pour obtenir la représentation de Lewis de cette molécule, il faut procéder en plusieurs étapes :
pour chaque atome constituant la molécule, on recherche le nombre de liaisons et de doublets non liants : H a 1 liaison et C a 4 liaisons ;
puis on dessine les atomes en faisant apparaître le bon nombre de liaisons de covalence (cf. formule ci-contre) ;
il n’y a pas besoin d’ajouter de doublet non liant car ses atomes n’en possèdent pas. On vérifie que chaque atome dispose bien de 4 doublets autour de lui (un doublet dans le cas de l’hydrogène).
Exemple 2
La molécule de dioxygène O2 comporte une double liaison : O=O, et chaque atome d’oxygène forme 2 liaisons de covalence et garde 2 doublets non liants :

La molécule d’eau comporte donc 2 liaisons OH : l’atome d’oxygène forme 2 liaisons de covalence et garde 2 doublets non liants :
La molécule de dioxyde de carbone comporte 2 double liaisons C=O :
La molécule de chlorure d’hydrogène comporte une liaison simple H—Cl :
La molécule de cyanure d’hydrogène comporte une liaison triple CN :
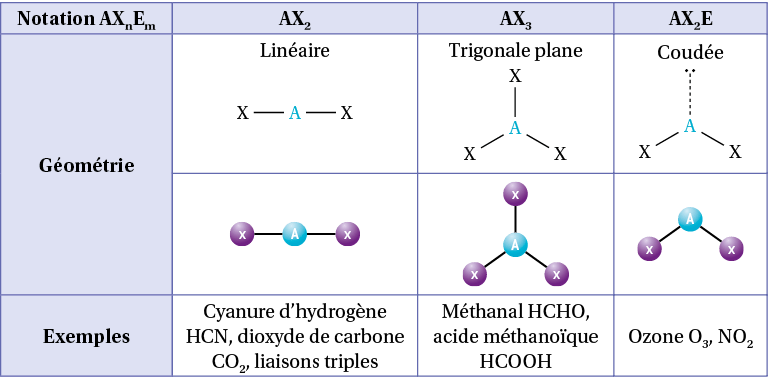
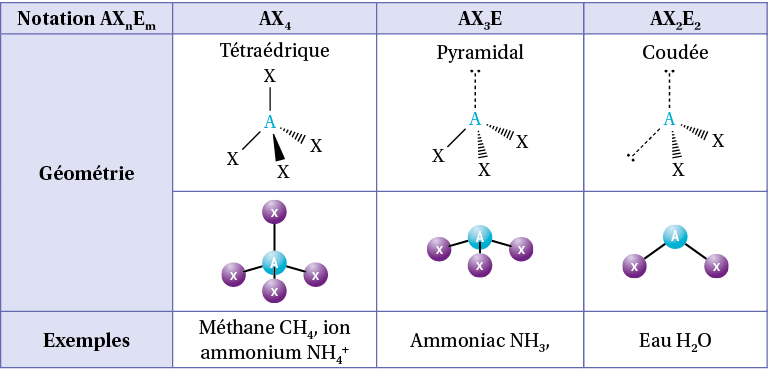
D) Géométrie : la méthode VSEPR
À partir de la représentation de Lewis, il est possible de connaître la géométrie autour d’un atome en utilisant la méthode VSEPR (valence shell electron pair repulsion) qui consiste à indiquer la géométrie qui minimise les répulsions électriques autour d’un atome. En effet, les doublets liants et non liants comportent chacun deux électrons, ils doivent donc se répartir autour de l’atome afin d’être le plus éloigné possible les uns des autres.
Pour cela, on note AXnEm :
A : l’atome central ;
Xn : n le nombre de liaisons autour de l’atome central. Une liaison double compte comme une liaison simple ;
Em : m le nombre de doublets non liant autour de l’atome central.
Exemples
Pour le méthane CH4, l’atome de carbone central a 4 liaisons simples et aucun doublet non liant, sa notation VSEPR est AX4.
Pour l’eau H2O, l’atome d’oxygène central a 2 liaisons simples et 2 doublets non liants, sa notation VSEPR est AX2E2.
Pour le cyanure d’hydrogène HCN, l’atome de carbone central a une liaison simple, une triple liaison et aucun doublet non liant, sa notation VSEPR est AX2.
On utilise alors un tableau permettant d’obtenir la répartition des liaisons et doublets non liants selon la somme n + m :
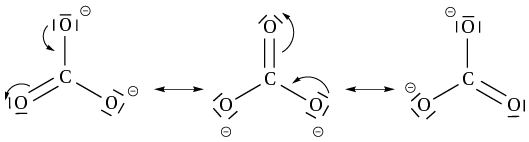
E) Exemple d’écriture de formes mésomères : l’anion carbonate CO32–
Les ions carbonates sont présents dans le calcaire, sous forme carbonate de calcium ou de magnésium, CaCO3 ou MgCO3. Dans l’anion carbonate, l’atome de carbone est l’atome central, il est lié à 3 atomes d’oxygène et toutes les liaisons C—O ont la même énergie de liaison, la même distance internucléaire et le même angle valenciel de 120°. Le nombre d’électrons de valence total dans l’ion carbonate est :
4 électrons de valence apportés par C ;
6 électrons de valence apportés par chacun des atomes d’oxygène, soit au total 18 ;
2 électrons supplémentaires puisque l’ion est chargé négativement avec 2 charges.
Soit un total de 24 électrons de valence à répartir dans 12 doublets liants/non liant, simples/multiples, de telle sorte à ce que les atomes de carbone et d’oxygène vérifient tous la règle de l’octet (atome de la seconde période).
Chaque carbone peut avoir 4 doublets liants, une double liaison et 2 liaisons simples. Il faut écrire 3 formes mésomères qui interviennent avec le même poids dans la représentation de la molécule car elles sont toutes symétriques, soit un poids de 1/3 pour chacune des formes. En effet, chacune des formes mésomères symétriques intervient avec un poids identique dans la représentation de 1/3 :
La liaison CO dans l’ion carbonate n’est ni simple, ni double mais entre les deux. Ainsi toutes les liaisons C—O sont identiques, soit pour 1/3 à caractère de double liaison et pour 2/3 à caractère de liaison simple.
Les liaisons covalentes polarisées
A) L’électronégativité
L’électronégativité d’un atome est une valeur numérique, indiquant la capacité de l’atome à attirer à lui le doublet d’électrons engagé dans une liaison de covalence : plus son électronégativité est forte plus il est attracteur.

Dans le cas d’une liaison entre 2 éléments A et B, on calcule la différence d’électronégativité entre les deux :
si la différence est inférieure ou égale à 0,4, la liaison est apolaire, le doublet d’électrons est équitablement réparti : A—B (H—H, C—H…)
si la différence est comprise entre 0,5 et 2, la liaison est polaire, la probabilité de présence du doublet d’électrons est plus grande vers B, l’élément le plus électronégatif : Aδ+—Bδ−. A porte alors une charge partielle positive δ+ et B, porte alors une charge partielle négative δ−(Oδ−—Hδ+, Cδ+—Clδ−) ;
si la différence est supérieure à 2, la liaison est ionique : B, l’élément le plus électronégatif porte une charge négative entière – et A une charge positive entière + : A+ + B– (Na+ + F–, Na+ + Cl–).
B) Les molécules polaires
Lorsqu’une molécule comporte une ou plusieurs liaisons polarisées, alors le barycentre des charges partielles positives et le barycentre des charges partielles négatives ne sont pas forcément au même endroit : la molécule est alors dipolaire.
Exemples
L’eau comporte 2 liaisons OH polarisées qui se répartissent dans un plan : le barycentre des charges positives se place au milieu des deux éléments hydrogène, ce qui ne coïncide pas avec le barycentre des charges négatives, qui est l’élément oxygène. L’eau est donc un solvant polaire.

Le dioxyde de carbone comporte deux liaisons CO qui se répartissent sur un segment : δ−O=C2δ+=Oδ−. Ici le barycentre des charges négatives se place sur le carbone, qui est l’unique centre de charges positives : cette molécule n’est donc pas dipolaire. Elle est apolaire.
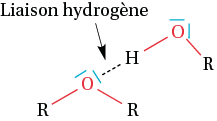
C) La liaison hydrogène
Les liaisons O—H et N—H sont polaires. Il peut s’établir une liaison hydrogène entre l’élément hydrogène d’une liaison O—H ou N—H d’une molécule et un élément électronégatif porteur d’un doublet non liant comme l’oxygène ou l’azote d’une autre molécule (éventuellement la même).
On montre ici, une liaison hydrogène présente entre des molécules comportant une fonction alcool. Cette liaison est moins forte qu’une liaison covalente, mais elle permet d’expliquer pourquoi la molécule d’ADN a une structure hélicoïdale ou pourquoi la glace fond à 0 °C.
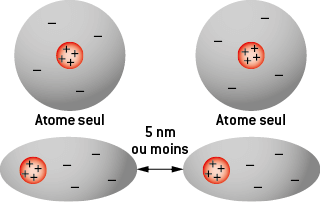
D) Les interactions de Van der Waals
L’interaction de Van der Waals est une interaction électrique attractive de faible intensité entre des atomes, des molécules à courte distance. Les forces de Van der Waals sont d’autant plus grandes que les électrons sont nombreux et la molécule étendue.
E) Les énergies des liaisons
L’énergie nécessaire pour rompre une liaison covalente (liaison intramoléculaire) est de l’ordre de plusieurs centaines de kilojoules par mol ce qui une dizaine de fois plus élevé que pour rompre une liaison hydrogène (liaison intra ou intermoléculaire). Dans le cas de l’interaction de Van der Waals (interaction intermoléculaire), l’ordre de grandeur est de quelques kilojoules par mol. Une liaison de covalence est donc nettement plus solide qu’une liaison hydrogène, elle-même plus solide qu’une interaction de Van der Waals.
L'énergie de changement d'état et structures
Les températures ou énergies de changement d’état donnent des informations précises sur la force des interactions entre molécules.
Un alcane a une température de fusion et d’ébullition d’autant plus grande que sa chaîne est longue, car les interactions de Van der Waals sont plus fortes si la molécule est plus étendue. De plus, les alcanes ont des températures de fusion et d’ébullition basses par rapport aux alcools contenant le même nombre d’atomes de carbone car il y a des liaisons hydrogène entre les molécules d’alcool, qui ne sont pas présentes entre les molécules d’alcane, qui ne disposent que d’interactions de Van der Waals. La liaison hydrogène étant plus forte que l’interaction de Van der Waals, il faut plus d’énergie pour la rompre et donc une température de changement d’état plus élevée.