Les molécules en chimie organique
A) La représentation
Une molécule peut être représentée par sa formule brute, mais celle-ci n’apporte pas beaucoup d’informations.
a) La formule développée plane
Cette formule est plus utile : tous les atomes apparaissent dans le même plan, ainsi que toutes les liaisons entre ces atomes. Les angles de représentation entre les liaisons sont de 90°, (120° lorsqu’il y a des doubles liaisons), ceci ne correspond pas à la réalité géométrique de la molécule. Cette représentation apporte des informations supplémentaires : type de liaisons et groupes caractéristiques. La molécule peut être nommée. L’éthanol s’écrit :
b) La formule semi-développée (plane)
Elle est plus rapide à écrire, en gardant les mêmes informations. On supprime simplement les liaisons mettant en jeu l’hydrogène. L’éthanol s’écrit alors : CH3—CH2—OH.
c) La formule de Lewis
On ajoute les doublets non liants à la formule développée plane au semi-développée. C’est la formule la plus complète. L’éthanol s’écrit :

d) La formule topologique ou représentation topologique
Une molécule organique contient systématiquement du carbone et de l’hydrogène. De plus, la chaîne carbonée se place sous forme de ligne brisée dans l’espace. On représente alors la molécule sous forme de segments, chaque extrémité de segment représentant un atome de carbone. Les atomes d’hydrogène reliés directement aux atomes de carbone ne figurent pas sur la représentation. Les groupes caractéristiques sont représentés de manière explicite ainsi que les atomes d’hydrogène qu’ils portent.
Remarque
Cette partie concerne uniquement la filière STL.
Attention
Dans cette représentation, l’extrémité liée à l’oxygène n’est pas un atome de carbone. Il n’y a que deux atomes de carbone dans l’éthanol qui s’écrit :

B) Les groupes caractéristiques
Une molécule organique comporte un groupe caractéristique ou un groupe fonctionnel lorsqu’elle contient au moins un atome autre que le carbone ou l’hydrogène.
Des molécules ayant un même groupe caractéristique ont des propriétés chimiques semblables. Elles appartiennent à une même famille.

Exemples
La molécule CH3—CH2—CH2—CHOH—CH3 comporte la fonction alcool et a pour formule brute C5H12O.
La molécule CH3—CH(CH3)—COOH comporte la fonction acide carboxylique et a pour formule brute C4H8O2.
C) L’isomérie
2 molécules ayant la même formule brute mais une formule semi-développée différente sont des isomères (de constitution). Il en existe trois catégories :
Remarque
Les parties C, D et E concernent uniquement la filière STL.
de chaîne : CH3—CH2—CH2—CH3 et CH3—CH(CH3)—CH3 ;
de position : CH3—CHOH—CH3 et CH3—CH2—CH2OH ;
de fonction : CH3—CO—CH3 et CH3—CH2—CHO.
D) La représentation de Cram
On peut représenter des molécules dans l’espace avec la représentation de Cram :
les liaisons dans le plan utilisent des traits fins :
les liaisons en arrière du plan sont en pointillé :
les liaisons en avant du plan sont un triangle plein :
E) Les conformations
2 molécules peuvent avoir la même formule semi-développée mais être non superposables (donc non identiques) : ce sont des stéréo-isomères. Si on passe de l’une à l’autre par une simple rotation, ce sont alors des conformères.
Ainsi, l’éthane, de formule brute C2H6, de formule semi-développée CH3—CH3 comporte une infinité de conformations, dont deux particulières sont :
La nomenclature
A) Les alcanes
Les alcanes sont des hydrocarbures ne comportant que du carbone et de l’hydrogène, ainsi que des liaisons simples. La formule brute d’un alcane non cyclique est CnH2n+2.
Les ramifications possibles sont :
—CH3 : méthyl et —C2H5 : éthyl.
Pour nommer un alcane, il faut rechercher la chaîne carbonée la plus longue possible. Le sens de la numérotation des atomes de carbone est tel que le nombre formé par la somme des indices rassemblés est minimum.
Exemple

1. La chaîne la plus longue est soulignée, elle a 6 éléments carbone : c’est un hexane.
2. On cherche alors les substituants, il y a deux CH3 et un C2H5. Dans l’ordre alphabétique, éthyl se place avant méthyl et comme il y a deux méthyls, la molécule est éthyl-diméthylhexane.
3. Il faut trouver les indices de position, si on compte en commençant à gauche, on aura les méthyls placés sur les carbones 2 et 5 et l’éthyl porté par le carbone 3 ; si on commence à droite, on aura les méthyls sur les carbones 2et 5 et l’éthyl sur le carbone 4. Il faut donc numéroter la chaîne à partir de la gauche. La molécule se nomme donc : 3-éthyl-2,5-diméthylhexane.
B) Les alcènes
Remarque
Cette partie concerne uniquement la filière STI2D.
Les alcènes sont des hydrocarbures ne comportant que du carbone et de l’hydrogène, des liaisons simples et au moins une liaison double C=C. La formule brute d’un alcène non cyclique est CnH2n.
Pour nommer un alcène, il faut procéder comme pour les alcanes : on cherche la chaîne carbonée la plus longue contenant la double liaison. La chaîne est numérotée pour que la double liaison ait l’indice le plus petit. La terminaison d’un alcène est -ène.
Exemple
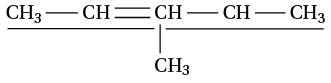
1. La chaîne la plus longue comportant la double liaison est soulignée, elle a 5 éléments carbone : c’est un pentène.
2. On numérote la chaîne à partir de la gauche pour que la double liaison ait l’indice le plus petit : pent-2-ène car la double liaison est entre le deuxième et le troisième atome de carbone.
3. On cherche alors les substituants, il y a un –CH3 sur le quatrième atome de carbone de la chaîne principale, la molécule est 3-méthylpent-2-ène.
C) Les alcools
Les alcools sont des hydrocarbures comportant du carbone, de l’hydrogène et au moins un oxygène formant une fonction —OH. La formule brute d’un alcool non cyclique est CnH2n+2O.
Pour nommer un alcool, il faut procéder comme pour les alcanes : on cherche la chaîne carbonée la plus longue contenant la fonction —OH. La chaîne est numérotée pour que la fonction –OH ait l’indice le plus petit. La terminaison est -ol.
Exemple

1. La molécule comporte la fonction alcool –OH, le nom se terminera par –ol.
1. La molécule comporte la fonction alcool –OH, le nom se terminera par –ol.
2. La fonction est portée par une chaîne à 4 carbones, c’est un butan-1-ol : la chaîne est numérotée à partir de la droite pour que l’alcool ait l’indice le plus petit.
3. Il y a une ramification méthyl, placée sur le troisième carbone, la molécule se nomme donc : 3-méthylbutan-1-ol, c’est un alcool primaire.
D) Les amines
Les amines sont des hydrocarbures comportant une fonction —NH2. La formule brute d’une amine non cyclique est CnH2n+3N.
Remarque
Les parties D et E concernent uniquement la filière STL.
Pour nommer une amine, il faut procéder comme pour les alcools : on cherche la chaîne carbonée la plus longue contenant la fonction —NH2. La chaîne est numérotée pour que la fonction —NH2 ait l’indice le plus petit. La terminaison est –amine.
E) Les aldéhydes et les cétones
Les aldéhydes et les cétones sont des hydrocarbures comportant une fonction —C=O. La formule brute d’un aldéhyde ou d’une cétone non cyclique est CnH2nO. Les aldéhydes portent cette fonction en bout de chaîne comme le propanal : CH3—CH2—CHO et il n’y a pas d’indice de position pour la fonction (c’est le carbone 1 de manière implicite). Pour les cétones, la fonction n’est pas en bout de chaîne comme la butan-2-one : CH3—CO—CH2—CH3.
F) Les acides carboxyliques
Les acides carboxyliques sont des hydrocarbures ayant une fonction –COOH. La formule brute d’un acide carboxylique non cyclique est CnH2nO2. Les acides carboxyliques portent cette fonction en bout de chaîne comme l’acide butanoïque : CH3—CH2—CH2—COOH et il n’y a pas d’indice de position pour la fonction (c’est le carbone 1 de manière implicite).
Un acide gras est un acide carboxylique ayant une chaîne contenant de 4 à 28 atomes de carbone, en général en nombre pair. Ils sont à longue chaîne pour une longueur de 14 à 24 atomes de carbone et à très longue chaîne au-delà. On le note R—COOH.
Ils peuvent être :
saturés, il n’y a que des liaisons simples :
acide palmitique : CH3(—CH2)14—COOH,
acide stéarique : CH3(—CH2)16—COOH ;
insaturés avec une ou plusieurs doubles liaisons C=C :
acide oléique : CH3(—CH2)7—CH=CH(—CH2)7—COOH,
acide α-linoléique : CH3(—CH2)3(—CH2—CH=CH)2(—CH2)7—COOH.
G) Bilan
Un nom de molécule est donc attribué de la manière suivante :
Les acides-aminés
Remarque
Cette partie concerne uniquement la filière STL.
A) Définitions
Un acide α-aminé est un composé organique portant sur un même atome de carbone, une fonction amine primaire –NH2 et un groupe acide carboxylique –COOH. Le « alpha : α», signifie que le groupe NH2 est porté sur le carbone adjacent à COOH.
Dans le nom acide aminé, on retrouve les fonctions acide carboxylique et amine.
L’atome de carbone porteur de ces 2 fonctions est lié à 1 atome d’hydrogène et à 1 chaîne latérale R. Pour l’acide aspartique R = —CH2—COOH et pour la phénylalanine R = —CH2—C6H5.
B) Le carbone asymétrique
Un carbone est asymétrique s’il comporte 4 atomes ou groupes d’atomes différents. On le met en évidence en le marquant d’un petit astérisque : C*. Tous les acides aminés sauf le plus simple, la glycine, ont au moins un carbone asymétrique dans leur formule.
Exemple
Le carbone pointé de l’alanine porte : 1 H, 1 COOH, 1 CH3 et 1 NH2. Ces quatre groupes d’atomes sont différents donc ce carbone est asymétrique.
Il n’y a pas de carbone asymétrique dans la glycine car le carbone porteur de NH2 et de COOH, est lié à deux H. Il n’y a donc pas 4 groupes d’atomes différents.

C) La chiralité des acides α-aminés
Nos deux mains ne peuvent pas se superposer l’une sur l’autre, par contre elles sont symétriques l’une de l’autre par rapport à un plan ou dans un miroir plan. Nos deux mains sont chirales.
Une molécule comportant un carbone asymétrique peut exister sous deux formes différentes dans l’espace : ce sont deux isomères de configuration appelés énantiomères, représentés avec la méthode de Cram :
Ces 2 molécules d’alanine ne sont pas superposables mais elles sont symétriques par rapport à plan. Elles ont la même formule semi-développée, elles sont chirales.
2 molécules sont énantiomères lorsqu’elles sont symétriques par rapport à un plan, mais non superposables. Elles ont la même formule semi-développée, ce sont des stéréoisomères.










