La couleur d’une solution est liée à son absorbance, grandeur mesurable grâce à un spectrophotomètre. La loi de Beer-Lambert permet d’associer l’absorbance d’une solution à sa concentration.
I. Absorbance et spectre d’absorption
Lorsque de la lumière blanche traverse une solution colorée, des radiations lumineuses sont absorbées par cette solution. Exemple : une solution magenta absorbe le vert, donc la lumière qui en sort est magenta.
L’absorbance A correspond à la proportion de lumière absorbée par une solution, à une certaine longueur d’onde.
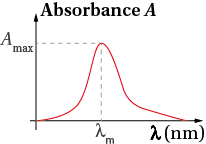
On mesure l’absorbance A d’une solution à différentes longueurs d’onde : on obtient ainsi le spectre absorption, c’est-à-dire la courbe A = f(λ).
On détermine la valeur de la longueur d’onde λm pour laquelle l’absorbance de la solution sera maximale. À λm, la valeur de l’absorbance étant maximale, l’incertitude sur la mesure de A sera minimale.
II. Loi de Beer-Lambert
La loi de Beer-Lambert s’écrit :
A = ℓ × ε × C
avec A absorbance de la solution (sans unité), C concentration en quantité de matière de l’espèce colorée en solution (mol · L−1), ℓ épaisseur de solution traversée (cm), ε coefficient d’extinction molaire (L · mol−1·cm−1), qui dépend de l’espèce absorbante, de λ et de la température.
À noter
La proportionnalité entre A et C n’est valable que pour les solutions diluées (C < 10−2 mol · L−1).
L’intérêt de cette loi est de lier par proportionnalité, l’absorbance (facilement mesurable) à la concentration en quantité de matière d’une espèce colorée.
Méthode
Déterminer une concentration par spectrophotométrie
On cherche la concentration en quantité de matière d’une solution aqueuse inconnue de sulfate de cuivre. On dispose pour cela d’une solution aqueuse S0 de sulfate de cuivre de concentration connue et d’un spectrophotomètre.
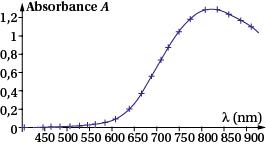
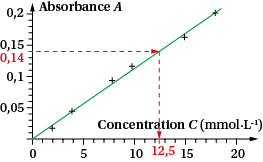
| Doc1 Spectre d’absorption d’une solution de sulfate de cuivre | Doc2 Courbe d’étalonnage d’une solution de sulfate de cuivre |
|
|
|
a. Quelle longueur d’onde choisir pour tracer la courbe d’étalonnage ?
b. Comment obtenir la courbe du document 2 ? Qu’indique son allure ?
c. Les réglages du spectrophotomètre étant conservés, on mesure l’absorbance de la solution inconnue de sulfate de cuivre. On trouve : Asol = 0,14. Comment déterminer Csol, la concentration de la solution ?
Conseils
c. Utilisez la courbe d’étalonnage pour associer une concentration à la valeur d’absorbance mesurée Asol.
Solution
a. Sur le doc.1, l’absorbance est maximale pour : λm = 800 nm.
b. À partir de S0, solution mère de sulfate de cuivre, on réalise une échelle de teinte : des solutions filles de concentration connue, diluées à partir de la solution mère. On mesure alors l’absorbance pour chaque solution fille.
Aux erreurs expérimentales près, les points sont alignés et la droite d’étalonnage passe par l’origine. Cette fonction est linéaire : l’absorbance est proportionnelle à la concentration de la solution. La loi de Beer-Lambert est vérifiée.
c. On place la valeur mesurée de l’absorbance sur l’axe des ordonnées pour trouver, via la droite d’étalonnage, l’abscisse qui lui correspond.
On obtient : Csol = 12,5 × 10−3 mol · L−1.
Vérifiez que vous avez bien compris les points clés des fiches 1 à 4.