Un corps pur est une substance constituée d’une seule espèce chimique, par exemple l’eau pure , le dioxygène ... Lorsque plusieurs espèces chimiques coexistent, on a affaire à un mélange : par exemple l’air, l’eau minérale...
1 - Le mélange hétérogène
On peut distinguer plusieurs constituants à l’œil nu.
Exemple : eau + sable, eau + poivre, eau + huile...
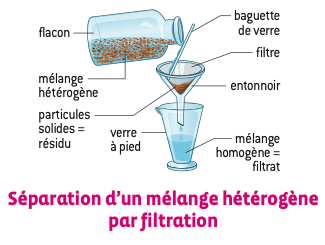
2 - Méthodes de séparation d’un mélange hétérogène : la décantation et la filtration
La décantation : cette méthode consiste à laisser reposer le mélange pendant un certain temps. Dans le cas d’un mélange avec de l’eau par exemple, les corps, plus denses que l’eau (densité supérieure à 1), vont se rassembler au fond du récipient et les corps moins denses (densité inférieure à 1) vont venir en surface.
La filtration : cette méthode consiste à faire passer le mélange au travers d’une membrane ou d’une substance poreuse. Le filtre permet de retenir les particules solides (le résidu). Plus la maille du filtre est fine, plus le filtrat sera limpide.
3 - Le mélange homogène
Après agitation, on ne distingue plus à l’œil nu les différents constituants du mélange.
Exemple : eau + sel, eau + alcool...
Dans la plupart des cas, un mélange homogène résulte de la dissolution d’un corps dans un autre, généralement liquide : le corps dissous (soluté) se mélange au liquide principal (solvant). La masse totale se conserve au cours d’une dissolution. Le mélange obtenu est appelé solution.
L’eau est un solvant de certains solides et de certains gaz. Le soluté est dit soluble (terme utilisé si c’est un solide ou un gaz) ou miscible (terme utilisé si c’est un liquide).
4 - Méthodes de séparation d’un mélange homogène
Quand on a une solution d’eau salée, par exemple, on peut réaliser un changement d’état de l’eau (le passage de l’eau à l’état liquide à l’eau à l’état gazeux) soit par évaporation soit par ébullition. On pourra récupérer le sel après.
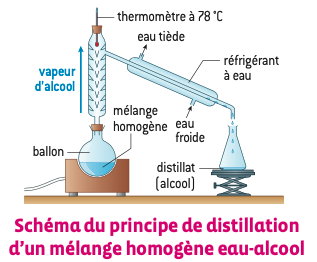
Quand on a un mélange eau + alcool, on peut réaliser une distillation.
La distillation permet de séparer deux liquides d’un mélange homogène en mettant en jeu deux changements d’état successifs : une vaporisation (de type ébullition) suivie d’une liquéfaction.
Ce procédé est utilisable quand les températures d’ébullition des deux liquides sont différentes, comme c’est le cas par exemple pour l’eau et l’alcool (100 °C et 78 °C). Dans une distillation, le premier liquide à subir une vaporisation est l’alcool, à 78 °C. On peut donc le recueillir à ce moment-là. Dès que le thermomètre recommence à monter, cela veut dire qu’il ne reste que de l’eau dans le ballon. On peut alors arrêter la distillation.
5 - Saturation et concentration massique
La saturation : on ne peut pas dissoudre autant de solide que l’on veut dans une quantité de liquide donnée. Par exemple, si l’on ajoute du sel dans un verre d’eau, celui-ci se dissout, puis si l’on continue à en ajouter, il arrive un moment où le sel ne se dissout plus : la solution est dite saturée.
Exemple : À 10 °C, on ne peut pas dissoudre plus de 36 g de sel dans 100 mL d’eau. La température joue un rôle important dans la solubilité. En effet, pour un volume donné, plus la température du solvant est élevée, plus on peut dissoudre de soluté.
La concentration massique cm est égale à la masse m de soluté sur le volume V de solvant soit cm = m / V = 36 / 100.10-3 = 360 g/L.
La concentration de la solution saturée, ici, est de 360 g/L.
Je m'entraine
En chahutant avec sa sœur Solène, Manon a laissé tomber sa salière et sa poivrière. Les contenus se sont mélangés. De quelle façon pourrait-on récupérer uniquement le sel?