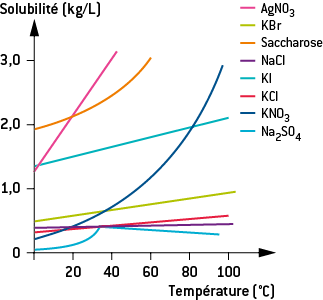Du noyau à la masse molaire
A) La notation symbolique du noyau d’un atome
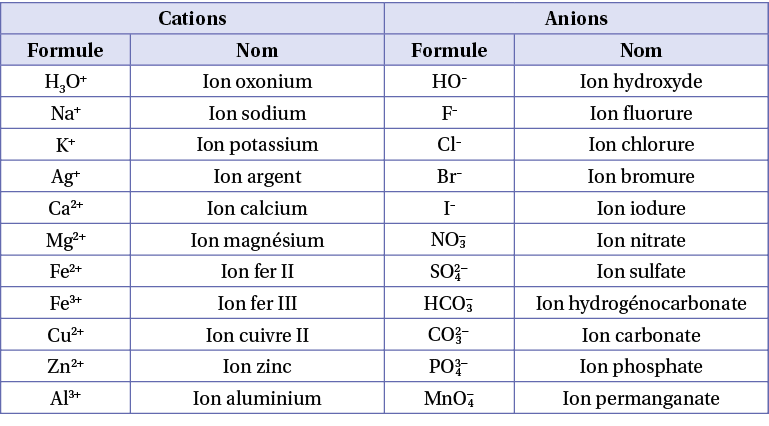
Un élément est caractérisé par son numéro atomique Z (ou nombre de charge) et par son nombre de masse A (ou nombre de nucléons). La notation symbolique d’un noyau atomique est (Z : protons ; N : neutrons ; A = Z + N).
Exemple
Le noyau comporte 232 nucléons dont 90 protons et 232 – 90 = 142 neutrons.
B) Les isotopes et la masse molaire atomique
Les isotopes d’un élément ont même numéro atomique, donc un nombre égal de protons, mais ils diffèrent par leur nombre de neutrons N, donc également par A.
2 noyaux isotopes représentent le même élément chimique et ont la même charge électrique mais pas la même masse. Ils peuvent avoir des propriétés différentes : certains sont stables et d’autres radioactifs. Pour séparer des isotopes, on utilise des méthodes physiques.
Exemple
Dans la série : , , les noyaux isotopes ont le même nombre de protons. On peut trouver les noyaux isotopes du carbone Z = 6 : et , et ceux de l’oxygène Z = 8 : et .
Un élément chimique comporte souvent plusieurs isotopes, sa masse molaire atomique dépend de la proportion de chaque isotope. Ainsi, l’élément chlore comporte 25 % de chlore 35 et 75 % de chlore 37, donc M(Cl) = 0,25 × M(35Cl) + 0,75 × M(37Cl) = 35,5 g.mol–1.
C) La détermination d’une masse molaire
La masse molaire moléculaire est calculée à partir des données du tableau périodique en faisant la somme des masses molaires atomiques de tous les atomes de l’espèce chimique. Dans le cas d’un ion, on procède de la même manière, les charges électriques ne modifient pas la masse globale de l’espèce.
Définition
Masse molaire moléculaire : c’est la masse d’une mole de molécules.
Exemples
La molécule de méthane CH4 contient 1 élément carbone et 4 éléments hydrogène. Sa masse molaire moléculaire se calcule facilement : M(CH4) = M(C) + 4M(H) soit M(CH4) = 12,0 + 4 × 1,0 = 16,0 g.mol–1.
De même, l’aspirine de formule C9H8O4 a pour masse molaire :
M(C9H8O4) = 9 M(C) + 8M(H) + 4 M(O) = 9 × 12,0 + 8 × 1,0 + 4 × 16,0 = 180 g.mol–1.
La préparation de solutions
A) La masse volumique et la densité
La masse volumique d’un corps, notée ρ, est la masse d’une unité de volume de ce corps. Elle s’exprime en kg.m–3 dans le système international, mais on emploie surtout l’unité g.cm–3au laboratoire. Elle se calcule en effectuant le rapport de sa masse par son volume :
Remarque
Ainsi on peut écrire m = ρ × V.
La densité d’un liquide par rapport à l’eau, est le rapport de la masse volumique de ce liquide par celle de l’eau dans les mêmes conditions de pression et de température :
La densité a donc la même valeur que la masse volumique exprimée en g.cm–3 ou en g.mL–1.
EXEMPLE
La densité de l’éthanol pur est d = 0,79. Sa masse volumique vaut donc ρ = 0,79 g.ml–1.
La masse d’alcool contenue dans 90 ml d’éthanol pur est m = ρ × V = 0,79 × 90 = 71 g.
B) La pureté
Un liquide ou un solide ne contient pas forcément qu’une seule espèce chimique : des impuretés ont pu être introduites. La pureté s’exprime en pourcentage. Ainsi, dire qu’un liquide contient de l’acide sulfurique ayant une pureté de 98 %, signifie que dans 1,0 kg de ce liquide, il y a 0,98 kg d’acide sulfurique.
C) Les quantités de matière
On considère un échantillon de masse m d’une espèce chimique de masse molaire M. La quantité de matière n de cette espèce chimique est donnée par la relation générale :
Exemple
La quantité de matière de sodium, contenue dans une masse mNa = 15 g de ce métal, est nNa = soit avec M(Na) = 23,0 g.mol–1, nNa = = 0,65 mol.
Remarque
Si le solide ou le liquide n’est pas pur, il faut d’abord déterminer la masse de l’espèce contenue dans le solide ou le liquide proposé, en utilisant la pureté.
D) La concentration molaire C
La concentration molaire C d’une espèce chimique en solution est la quantité de matière de l’espèce chimique contenue par litre de solution. C’est le rapport de la quantité de matière de l’espèce chimique par le volume de solution. Elle s’exprime en mol.L–1.
Remarque
Il est souvent nécessaire de faire un calcul préalable de quantité de matière pour pouvoir déterminer la concentration molaire des solutions. La concentration molaire et la concentration massique sont liées par la formule : Cm = C × M, où M est la masse molaire de l’espèce considérée.
E) La dilution d’une solution aqueuse
Il est possible d’obtenir une solution aqueuse d’une espèce chimique de concentration donnée à partir d’une solution contenant la même espèce mais ayant une concentration plus importante.
La solution la plus concentrée s’appelle la solution mère et la solution diluée est la solution fille. Pour déterminer le volume de solution mère à prélever, on utilise la relation : Cfille × Vfille = Cmère × Vmère :
Cfille est la concentration de la solution diluée.
Cmère est la concentration de la solution mère.
Vfille est le volume final de la solution diluée.
Vmère est le volume à prélever de la solution mère.
Pour préparer une solution aqueuse de concentration précise par dilution, il faut utiliser de la verrerie jaugée. Le mode opératoire est le suivant :
rincer la pipette jaugée avec la solution mère ;
prélever le volume de solution mère avec la pipette jaugée munie d’une propipette ;
introduire le volume de solution mère dans une fiole jaugée (ayant le volume approprié) propre et remplie à moitié avec de l’eau distillée ou déminéralisée ;
compléter la fiole jaugée jusqu’au trait de jauge avec de l’eau déminéralisée. Homogénéiser.
La dissolution d'une espèce moléculaire ou ionique
A) Les solvants usuels
Une solution est obtenue par dissolution d’un soluté, solide ionique ou moléculaire dans un solvant. Il existe plusieurs types de solvants :
les solvants polaires, tels que l’eau (la solution est une solution aqueuse), l’éthanol : ils peuvent dissoudre des espèces polaires. Les molécules de solvant s’insèrent dans le soluté et le disperse. La solvatation est assurée par des liaisons hydrogène ou par stabilisation des charges électriques dans le cas des ions ;
les solvants apolaires, tels que l’hexane, le cyclohexane : ils peuvent dissoudre des espèces apolaires. La solvatation se fera par des interactions de Van der Waals.
B) La dissolution d’une espèce moléculaire
L’équation de réaction est alors : soluté(solide) → soluté(solvaté) : le solvant stabilise le soluté en solution.
C) La dissolution d’une espèce ionique
L’équation de réaction est alors : solide ionique(solide) → ions(solvaté) : le solvant, l’eau en général, stabilise les ions en solution.
La dissolution du solide ionique procède selon le schéma ci-dessous où l’on voit la dissociation du solide, l’hydratation des ions puis la dispersion dans l’eau :
La formule d’un solide ionique comporte le nombre minimal de cations et d’anions permettant la neutralité électrique. Elle commence toujours par la formule du cation.
Exemple
Le carbonate de sodium, Na2CO3, est constitué d’ions sodium Na+ et d’ions carbonate .
Ce tableau présente quelques ions : cation, chargés positivement et anion négativement.
Lors de la dissolution du solide ionique neutre électriquement, une solution aqueuse neutre électriquement se forme également et la concentration réelle des ions est égale à celle en solide ionique apporté multiplié par le coefficient stœchiométrique placé devant l’ion.
Exemples
On note C la concentration en solide ionique apporté.
L’iodure de potassium : KI(s) → + , K+ et I–ont tous les deux la concentration C.
Le sulfate de cuivre II :CuSO4(s) → + , Cu2+ et ont tous les deux la concentration C.
Le chlorure de fer III : FeCl3(s) → + , Fe3+ a la concentration C et Cl– a la concentration 3 C.
Le carbonate d’aluminium : Al2(CO3)3(s) → 2 + 3 , on note Al2(CO3)3 dans le solide ionique pour montrer que l’ion aluminium est présent deux fois et l’ion carbonate est présent trois fois. Al3+ a la concentration 2 C et a la concentration 3 C.
La solubilité
A) Définitions
La solubilité molaire est la quantité de matière maximale d’un soluté pouvant être dissoute par litre de solvant, elle s’exprime en mol par litre (mol.L–1).
La solubilité massique est la masse maximale d’un soluté pouvant être dissoute par litre de solvant, elle s’exprime en gramme par litre (g.L–1) et aussi en gramme par 100 grammes de solvant.
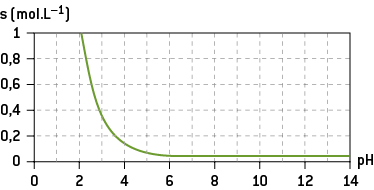
La solubilité dépend des conditions de température, de pH et de la présence d’autres espèces chimiques.
B) Les solutions saturées
Tant que la solubilité d’une solution n’est pas atteinte, la solution est homogène. À la limite de solubilité, la solution est saturée et au-delà la solution est hétérogène : il faut alors la filtrer pour qu’elle redevienne homogène en étant saturée.
C) La solubilité et la structure
La solubilité d’une espèce dépend de son affinité avec le solvant. En général, les solides ioniques et les substances polaires hydrophiles sont bien solubles dans l’eau. Les espèces lipophiles sont solubles dans les solvants organiques.
Une espèce hydrophobe aura une faible solubilité dans l’eau et sera facilement extraite par un solvant organique et inversement une espèce hydrophile aura une faible solubilité dans un solvant organique apolaire et sera facilement extraite par un solvant polaire ou l’eau.
Une espèce amphiphile possède une partie hydrophile (ionique ou polaire) et une partie hydrophobe (chaîne hydrocarbonée) :
Elles seront peu solubles de manière libre dans l’eau ou un solvant organique, mais elles peuvent adopter des structures en micelles qui accroissent leur solubilité et leur donnent un comportement différent selon que le solvant soit polaire ou apolaire :
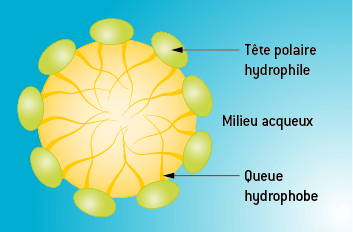
Micelle dans un milieu aqueux
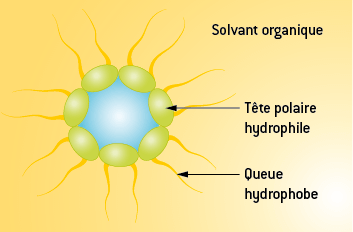
Micelle dans un solvant organique
D) La solubilité et le pH
La solubilité d’une espèce peut dépendre du pH : dans le graphe de la solubilité de l’éthanoate d’argent AgCH3COO, on remarque que ce solide ionique est beaucoup plus soluble en pH acide. Sa solubilité reste quasiment constante pour un pH supérieur à 5.
E) La solubilité et la température
En général, la solubilité d’une espèce augmente avec la température.