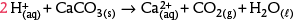Une transformation chimique est modélisée par une réaction chimique. Les équations chimiques sont ajustées pour traduire la conservation de la matière et des charges électriques.
I L’équation de la réaction et sa signification
Repère
Mot cléAqueux signifie que l’espèce est dissoute, en solution dans l’eau.
Une transformation chimique est modélisée par une réaction chimique dont l’équation indique les réactifs et les produits, représentés par leur formule et l’état physique des espèces : solide (s), liquide (ℓ), gaz (g) ou aqueux (aq). Elle indique les proportions des quantités qui interviennent mais pas les conditions dans lesquelles se déroule la réaction.
Les espèces chimiques présentes et qui ne réagissent pas sont appelées espèces spectatrices. Elles n’apparaissent pas dans l’équation chimique.
Exemple : La combustion du charbon qui brûle dans l’air est une transformation modélisée par la réaction entre le carbone et le dioxygène d’équation :
• À l’échelle microscopique : un atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone.
• À l’échelle macroscopique : une mole d’atomes de carbone réagit avec une mole de molécules de dioxygène pour former une mole de dioxyde de carbone.
• Les gaz présents dans l’air (diazote par exemple) sont des espèces spectatrices.
II Conservation de la matière et nombres stœchiométriques
Au cours d’une transformation chimique, il y a conservation des éléments chimiques et des charges électriques.
Dans l’équation, on place devant les formules, des nombres stœchiométriques que l’on ajuste pour traduire cette conservation (le nombre 1 n’est pas écrit).
Exemple : La réaction entre l’éthanol (C2H6O) et le dioxygène (O2) forme du dioxyde de carbone (CO2) et de la vapeur d’eau (H2O). Son équation est :
C2H6O(ℓ) + 3 O2(g) → 2 CO2(g) + 3 H2O(g)
Les nombres stœchiométriques (en rouge dans l’équation) renseignent sur les proportions dans lesquelles les réactifs sont consommés et les produits sont formés : 1 mole d’éthanol réagit avec 3 moles de dioxygène pour former 2 moles de dioxyde de carbone et 3 moles d’eau.
La conservation de la matière se manifeste à l’échelle macroscopique par la conservation de la masse totale du système chimique.
MéthodeÉcrire et ajuster des équations chimiquesLe gaz de ville est constitué de méthane de formule CH4 qui brûle en réagissant avec le dioxygène de l’air. Cette transformation exothermique est très utilisée pour le chauffage au gaz ; elle produit du dioxyde de carbone et de l’eau.
Les pluies acides attaquent le calcaire : les ions hydrogène H+ contenus dans les acides réagissent avec le carbonate de calcium CaCO3 constituant le calcaire. Il apparaît des ions calcium Ca2+, des molécules de dioxyde de carbone et d’eau.
Écrire les équations des réactions chimiques qui modélisent ces deux transformations.
Repère
ConseilsÉtape 1. Après avoir identifié les réactifs (espèces qui disparaissent) et les produits (espèces qui apparaissent), écrivez les formules brutes des différents constituants avec leur état physique : les réactifs à gauche et les produits à droite de la flèche.
Étape 2. Comptez les éléments présents de part et d’autre de la flèche : vérifiez qu’il y a le même nombre, sinon ajoutez, devant les formules, les nombres stœchiométriques qui permettent d’écrire la conservation.
Étape 3. Vérifiez la conservation des charges électriques.
SolutionÉtape 1. Pour la combustion du méthane, les réactifs sont : le méthane CH4(g) et le dioxygène O2(g) ; les produits : le dioxyde de carbone CO2(g) et l’eau H2O(g).
Pour l’attaque du calcaire, les réactifs sont : les ions hydrogène H+(aq), dissous dans l’eau de pluie, et le calcaire CaCO3(s) ; les produits : les ions calcium , le dioxyde de carbone CO2(g) et l’eau H2O(ℓ). Pour les deux réactions, on écrit les formules des espèces à gauche et à droite de la flèche :
CH4(g) + O2(g) → CO2(g) + H2O(g)
Étape 2. On ajuste pour écrire la conservation des éléments :
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
2 devant H2O permet d’écrire la conservation de l’hydrogène : 4 de chaque côté tandis que 2 devant O2 permet d’écrire la conservation de l’oxygène : 4 de chaque côté.
2 devant H+ permet d’écrire la conservation de H : 2 de chaque côté.
Étape 3. Seule la seconde situation comporte des charges électriques. Le nombre stœchiométrique 2 devant H+ permet d’avoir 2 charges positives avant et après la transformation. Les équations ci-dessus sont donc ajustées.