Légende de la leçon
Vert : définition
I. Les transformations chimiques et les générateurs électriques
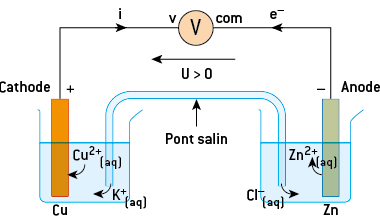
La polarité d’une pile permet de déterminer les demi-réactions se produisant au niveau de chaque électrode.
Dans le cas d’une pile cuivre-zinc, la tension mesurée entre l’électrode de cuivre connectée à la borne « volt » du voltmètre et l’électrode de zinc connectée à la borne « com » du voltmètre est positive :
- l’électrode de cuivre est donc la borne positive et l’électrode de zinc la borne négative ;
- l’oxydation se produit sur l’électrode négative, d’où sont issus les électrons, appelée anode. Il s’agit ici de l’électrode de zinc : Zn = Zn2+ + 2 e–. Cette électrode est consommée progressivement car le métal disparaît ;
- la réduction se produit sur l’électrode positive, qui reçoit les électrons, appelée cathode. Il s’agit ici de l’électrode de cuivre : Cu2+ + 2 e− = Cu. Il s’y produit un dépôt de cuivre.
Cette pile comporte les deux demi-piles contenant les couples Cu2+ (aq)/Cu (s) et Zn2+ (aq)/Zn (s). La réaction globale se produisant dans la pile est donc :
Zn (s) + Cu2+ (aq) → Zn2+(aq) + Cu (s).
Application
Écrire la réaction se produisant dans une pile argent-cuivre, mettant en jeu les couples Cu2+ (aq)/Cu (s) et Ag+ (aq)/Ag (s), sachant que l’électrode d’argent est la cathode.
Solution
L’électrode d’argent est la cathode, c’est-à-dire la borne positive où se produit la réduction : Ag+ + e− = Ag, ainsi qu’un dépôt d’argent. L’électrode de cuivre est donc négative, c’est l’anode où se produit l’oxydation : Cu = Cu2+ + 2 e–. L’électrode est consommée.
La réaction globale se produisant dans la pile est donc :
2 Ag+ (s)+ Cu (s) → 2 Ag+ (s) + Cu2+ (aq).
II. Le bilan de matière
1) La quantité d’électricité disponible Q
La charge électrique Q est aussi liée à l’intensité du courant électrique I délivrée et à la durée Δt pendant laquelle la pile débite :
La charge électrique Q est aussi liée à la quantité d’électrons ne ayant circulé dans le circuit électrique. Q = ne × F (voir le chapitre 13).
2) Le cas d’un accumulateur
On considère un accumulateur « nickel-métal-hydrure » (NiMH). La structure de ses électrodes est spiralée. À l’état chargé, l’électrode positive est constituée d’un oxyhydroxyde de nickel (NiO(OH)) et l’électrode négative d’un hydrure métallique. L’électrolyte est à base de potasse (KOH).
Les réactions chimiques aux électrodes sont :
au niveau de l’électrode positive : NiO(OH) + H2O + e–au niveau de l’électrode négative : MH + OH–Pour les deux demi-équations, l’accumulateur :
- se décharge avec les réactifs à gauche. L’équation globale est alors :
NiO(OH) + MH → Ni(OH)2 + M ;
- se charge avec les réactifs à droite. L’équation globale est alors :
Ni(OH)2 + M → NiO(OH) + MH.
Lorsque l’accumulateur se décharge, il alimente un appareil pendant une durée Δt avec une intensité I. Il transfère une charge Q = I × Δt à l’appareil. Or, on a aussi Q = ne × F. D’après la demi-équation contenant NiO(OH), il faut un électron par NiO(OH), donc ne = nNi. La durée de fonctionnement pour une intensité donnée lors de la décharge est directement liée à la quantité de nickel ou d’hydrure métallique de la pile : Δt = n×FI.
Inversement, lors de la charge, l’accumulateur est relié à un générateur imposant un courant d’intensité I (plus fort que le courant de décharge) circulant à l’envers du courant de décharge de l’accumulateur. Cette charge s’effectue pendant une durée Δt. On peut reprendre la même formule que précédemment : Δt = n×FI où n est la quantité de matière de NiO(OH) ou de MH à reformer.
Définition
Un hydrure métallique est un alliage capable d’absorber plus d’un atome d’hydrogène par atome métallique.
3) Le cas d’une pile à combustible
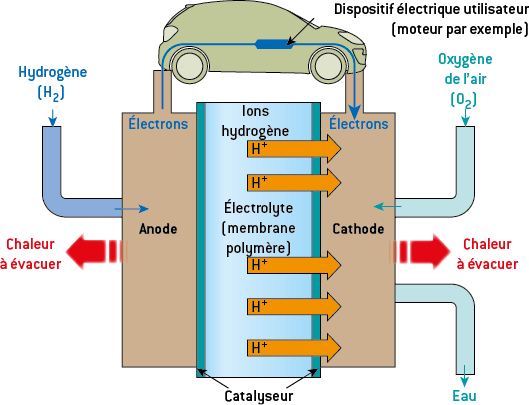
On considère une pile à combustible à hydrogène.
Le dihydrogène provient d’un réservoir sous pression contenant au départ une quantité de matière n de dihydrogène H2. L’autre réactif est le dioxygène O2 prélevé dans l’air ambiant : il est donc en excès. La pile pourra donc fonctionner tant qu’il reste du dihydrogène.
Les couples mis en jeu sont O2/H2O et H+/H2 :
- l’oxydation se fait sur l’anode, l’électrode négative d’où sont issus les électrons, donc celle où arrive le dihydrogène : H2 = 2 H+ + 2 e– ;
- la réduction se produit sur la cathode, l’électrode positive où arrivent les électrons, donc celle où arrive le dioxygène : O2 + 4 H+ + 4 e– = 2 H2O ;
- la réaction globale se produisant dans la pile est donc : O2 + 2 H2 → 2 H2O.
Lorsque la pile fonctionne, elle alimente un appareil ou un moteur pendant une durée Δt avec une intensité I. Elle transfère une charge Q = I × Δt = ne × F. D’après la demi-équation contenant le dihydrogène, il faut deux électrons par molécules de dihydrogène donc 2 ne = nH2. AinsiQ = I × Δt = ½ × nH2 × F. La durée de fonctionnement pour une intensité donnée lors de la décharge est directement liée à la quantité de dihydrogène : Δt = nH2×F2×I.
Exemple
Une pile à hydrogène comporte un réservoir contenant 80 mol de dihydrogène. Elle alimente un moteur avec une intensité I = 35 A. Cette pile pourra fonctionner durant Δt = nH2×FI = 80×96 5002×35= 1,1 × 105 s = 31 h. Cette durée est théorique, elle ne prend pas en compte les pertes énergétiques (effet Joule, réactions parasites, etc.).