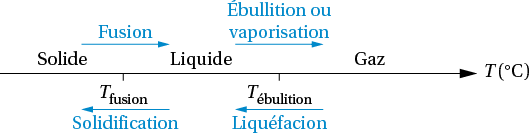Chaque espèce chimique possède ses propres caractéristiques physiques (températures de changement d’état, masse volumique, solubilité…) qui permettent de l’identifier.
I Températures de changements d’état
L’état physique, solide, liquide ou gazeux, d’une espèce chimique dépend des conditions de température et de pression.
Pour une pression donnée, le changement d’état d’une espèce chimique a lieu à une température fixe, appelée température de changement d’état.
Exemple : Pour l’eau : et .
II Masse volumique et solubilité dans un solvant
La masse volumique (rhô) est le quotient de la masse d’un échantillon sur le volume de cet échantillon.
Si est en g et en , alors est en . Si est en et en , alors est en . |
La masse volumique de l’eau : = 1,0 × 103 kg · m−3.
Repère
À noter1 kg = 103 g et 1 m3 = 106 cm3 d’où 1 kg · m−3 = 10−3 g · cm−3 ou 103 kg · m−3 = 1 g · cm−3.
Lorsqu’on mélange deux liquides non miscibles, celui qui a la masse volumique la plus faible surnage.
Exemple : On mélange de l’eau et du cyclohexane avec . < donc le cyclohexane se trouve au-dessus de l’eau.
L’air est un mélange de plusieurs gaz, constitué de 20 % de dioxygène et 80 % de diazote en volume. = 1,2 kg · m−3 à 20 °C sous la pression atmosphérique ( << ).
La solubilité d’une espèce chimique est la masse maximale que l’on peut dissoudre par litre de solution, dans un solvant donné. Elle s’exprime en . Si on dépasse cette valeur, le mélange est hétérogène : la solution est saturée.
MéthodeDéterminer la composition d’un mélangeOn réalise un mélange eau-alcool en prélevant un volume V1 d’alcool et un volume V2 d’eau à l’aide de deux éprouvettes graduées de 100 mL. On réalise ensuite le mélange dans une éprouvette graduée de 200 mL.
a. Quelle constatation peut-on faire au regard du schéma de ces trois éprouvettes ?
b. Déterminer la valeur de la masse volumique du mélange eau-alcool réalisé.
c. Quel est le pourcentage massique en alcool et en eau de ce mélange ?
Repère
Conseilsa. Le schéma permet de lire les volumes d’alcool, d’eau et du mélange. La lecture se fait au niveau de la base du ménisque.
Comparez le volume du mélange à celui de l’alcool et l’eau.
b. Définissez la masse volumique du mélange et identifiez les valeurs connues et inconnues. À partir des données et des schémas, déterminez ces inconnues.
c. Définissez la composition massique en alcool dans le mélange puis déduisez-en le pourcentage massique. La somme des pourcentages doit être égale à 100 %.
Solutiona. On constate que V1 = 51 mL et V2 = 60,0 mL or le volume du mélange Vmélange = 108 mL est inférieur à V1 + V2 = 111 mL. Au cours du mélange des deux liquides, il n’y a pas conservation du volume.
b. La masse volumique du mélange est égale au quotient de la masse du mélange sur le volume du mélange. Il y a conservation de la masse donc m = m1 + m2 ; il faut déterminerces deux masses :
et .
Le résultat obtenu est cohérent : ρ(alcool) < 0,926 g · mL−1 < ρ(eau).
c. Le mélange est réalisé avec 40 g d’alcool et 60 g d’eau pour une masse totale de 100 g. Il y a donc 40 % d’alcool et 60 % d’eau en masse dans ce mélange.